钙通道阻滞剂中毒急诊诊治专家共识
时间:2025-03-18 07:56 来源:中华急诊医学杂志,2025,3 作者:中华医学会急诊医 点击:次
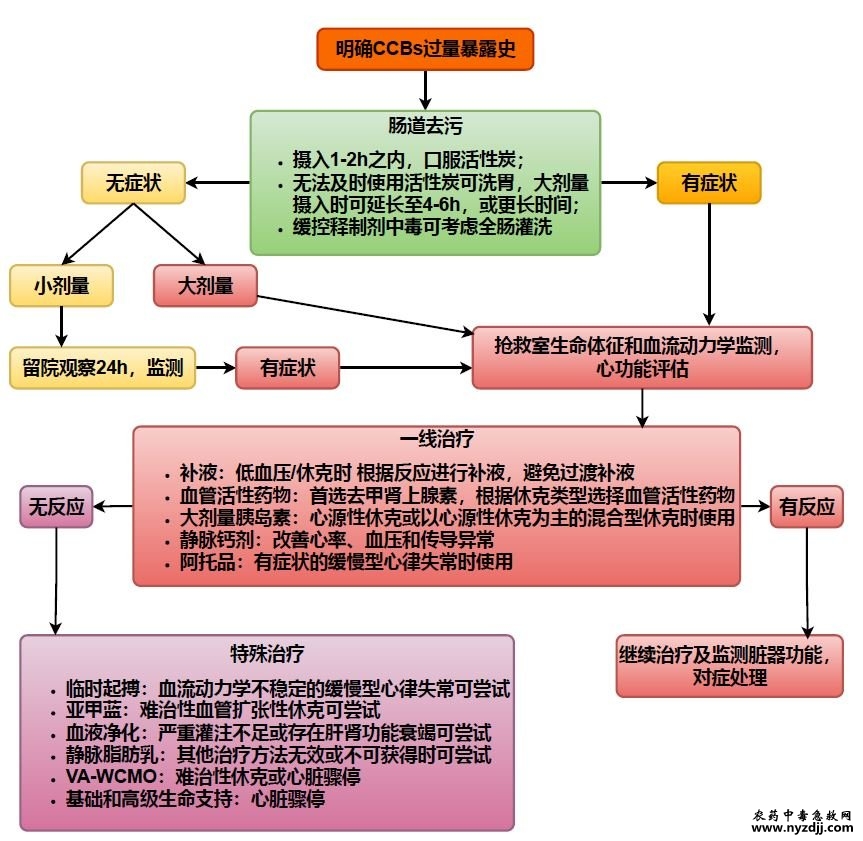
钙通道阻滞剂(calcium channel blockers, CCBs)又称钙拮抗剂,主要通过阻断心肌和血管平滑肌细胞膜上的钙离子通道,抑制细胞外钙离子内流,使细胞内钙离子水平降低而引起心血管等组织器官功能改变,是临床上最常用的一类心血管药物。CCBs分为二氢吡啶和非二氢吡啶两类,其中,二氢吡啶类的典型代表药物有硝苯地平、氨氯地平、尼莫地平、尼卡地平等,非二氢吡啶类典型代表药物有地尔硫䓬、维拉帕米。 美国中毒中心2022年的数据显示,心血管药物暴露是第六位的毒物暴露因素,而在因中毒导致死亡病例占比中,CCBs是第六大类别药物[1]。在CCBs中毒中,最常见的药物是氨氯地平,它是中毒导致死亡病例中占比最多的CCBs[1]。2022年,氨氯地平占国际多中心毒理学研究和监测网络报告的所有CCBs暴露的三分之二以上[2]。来自澳大利亚的两个毒理学服务机构2014-2023年的数据表示,在CCBs中毒中,二氢吡啶类最常见,其中氨氯地平占一半,值得注意的是,地尔硫䓬和维拉帕米中毒的临床后果更严重[3]。国内缺乏有关CCBs中毒的统计数据,1项来自单中心的2014-2021年的数据分析显示CCBs中毒病死率是28.8%[4]。目前的诊断和治疗建议主要来源于回顾性分析、病例报告和专家意见。我国缺乏此类疾病诊治方面的统一、规范方案,为此制定本CCBs中毒急诊诊治专家共识,以指导和规范急性CCBs中毒的救治管理。 共识制定方法与制订过程包括:提出关键问题,基于临床问题,以钙通道阻滞剂、中毒、过量为中文检索词, 以calcium channel blocker、poisoning及overdose为英文检索词搜索中国知网数据库、万方数据库、维普数据库、PubMed、EMBASE、Web of Science,检索时间截止至2024年10月。系统收集相关文献,撰写初稿,提交共识编写组专家函审提出修改意见。修订后召开专家讨论会确定终稿,再次提交共识编写组专家审核定稿。本共识注册号为PREPARE-2025CN016。 1 CCBs的药理学及毒理学机制 CCBs通过直接抑制L型钙通道钙离子的内流来发挥其治疗作用。CCBs主要有两类:二氢吡啶类(dihydropyridines,DHPs)和非二氢吡啶类(non-dihydropyridines, non-DHPs)。DHPs主要通过外周血管平滑肌发挥作用,主要用于治疗高血压;non-DHPs主要通过抑制心肌细胞中的钙通道起作用,主要用于治疗心绞痛和心律失常。CCBs阻断血管细胞钙离子通道后可使血管平滑肌舒张,收缩压降低和冠状动脉血流增加;通过阻断心肌细胞膜上的L型电压依赖性钙离子通道,抑制细胞外钙离子内流,进而减弱心肌收缩力、降低心率、降低窦房结、房室结自律性和传导性。 CCBs中毒的毒理作用往往是药理作用的延伸,DHPs中毒主要导致外周血管扩张,初期可引起反射性的心动过速,而non-DHPs中毒主要影响心脏传导、降低心肌细胞收缩力[5]。但在严重中毒情况下,这种相对选择性可能消失[6]。在心血管系统之外,胰腺β细胞中的L型钙通道被阻断可导致胰岛素释放减少,从而导致高血糖[7]。一般情况下,心肌细胞利用氧化脂肪酸作为能量来源,但在应激情况下,心肌细胞开始利用葡萄糖作为主要的能量来源[8]。CCBs过量引起的低胰岛素血症和胰岛素抵抗使心肌细胞不能自由地利用葡萄糖作为能量,这进一步降低了心脏的收缩力,导致休克[9]。心功能下降、血管扩张和低胰岛素血症导致的葡萄糖利用下降,共同解释了CCBs过量可能诱发危及生命的心血管系统崩溃的原因。另外,CCBs除可造成心源性肺水肿外,还可能通过对肺毛细血管的扩张作用引起非心源性的肺水肿[10-11]。 推荐意见1:CCBs中毒的毒理机制主要是通过直接抑制心脏、血管及胰腺β 细胞中的L型钙通道,导致外周血管平滑肌扩张、心肌收缩力减弱、心率减慢及血糖升高。 2 临床表现 CCBs中毒主要作用在心脏和血管两个方面: (1) 心脏方面:①反射性心动过速、心动过缓、不同程度的窦房或房室传导障碍、结性或室性自主心律;②心脏收缩力下降[5]。 (2) 血管方面:外周血管扩张。 综合以上两方面可造成心力衰竭、心源性肺水肿、低血压或休克(引起多脏器灌注不足表现,如脑灌注不足引发意识改变、癫痫发作等[12]),更为严重者可出现难治性休克和心脏骤停[5]。 (3) 其他表现:包括高血糖、非心源性肺水肿以及较为罕见的肠梗死和肠梗阻[13-14]。 3 诊断与鉴别诊断 3.1 诊断 有明确过量CCBs暴露史和符合CCBs中毒的临床表现,则临床诊断成立。CCBs血药浓度不影响临床救治[15],且血药浓度检测或者毒物检测不是所有地区均能获得,因此不推荐常规检测。值得注意的是,在常规检测无法解释的原因不明的休克和心动过缓的患者中,应想到中毒特别是心血管药物中毒可能[15],可通过毒物检测或血药浓度检测协助诊断。 3.2 鉴别诊断 其他心血管药物中毒,特别是β受体阻滞剂中毒,亦可出现相似临床表现[15],且CCBs 中毒在实际诊疗中经常合并其他药物特别是心血管药物中毒,可结合用药史、毒物检测或血药浓度检测进行鉴别。 推荐意见2:有明确过量CCBs暴露史,结合典型临床表现,可做出临床诊断。联合毒物检测结果可做出明确诊断。若毒物检测无法及时获得,则不推荐作为常规检测手段。 4 救治流程 4.1 急诊评估与分层 CCBs 在胃肠道吸收迅速,1~2h即出现临床表现,但CCBs的缓释、控释制剂或本身半衰期较长的CCBs如氨氯地平的起效时间和维持时间较其他CCBs更长。对于有CCBs明确过量史但无症状的就诊者,建议留院观察并监测至少24h[5,16]。在此期间对所有患者均应行血压、心率、呼吸、指端脉搏氧饱和度和意识检查,并完成12导联心电图检查。 对于有症状的患者或摄入大剂量的早期无症状/症状轻微的患者,应安置在抢救室,并迅速行血压、心率、心律、呼吸、指端脉搏氧饱和度监测、评估意识状态,完善12导联心电图、血乳酸、血气分析、血糖检测和胸部影像学、超声心动图检查。 推荐意见3:对于有明确过量服药但初诊时无症状的患者,推荐留院观察至少24h。对于有症状的或摄入大剂量药物的早期无症状/症状轻微的患者推荐在抢救室诊治,严密监测生命体征,评估心电活动、血液酸碱度和乳酸水平、血糖、胸部影像学及超声心动图改变。 4.2 胃肠道去污 在CCBs摄入1h内可以考虑应用活性炭,成人剂量为50g,但即使摄入1h以上应用活性炭仍可能获益[16]。如果发生可能危及生命的缓控释制剂中毒,在摄入后2h内可口服活性炭吸附CCBs以减少其全身吸收[17]。恶心和呕吐可能会妨碍活性炭的使用。活性炭的其他风险包括误吸,因此应避免用于有呼吸抑制、中枢神经系统抑制、癫痫发作或无法保护气道的患者。有研究表明在减少药物吸收方面,活性炭效果优于洗胃[18]。 在活性炭无法及时使用的情况下,早期胃肠道去污可考虑洗胃。洗胃的原则为愈早愈好,一般建议在服毒后1h内洗胃。但对于服用大剂量CCBs存在胃排空延迟风险时,洗胃可延长至4~6h甚至更长时间[19]。短时间口服超大剂量药物有形成“药石”风险,洗胃同时行胃镜下去污处理可能具有一定的临床意义[13,20]。对于预期可能出现中毒的缓控释制剂暴露,如血压尚正常、肠道灌注尚充足,可考虑应用高分子量聚乙二醇溶液进行全肠灌洗[15],用量是2L/h直至直肠流出物清亮[21]。洗胃或全肠灌洗均应在不影响主要治疗、生命体征平稳的情况下考虑,洗胃时还应注意对意识状态改变者行气道保护和对胃黏膜的保护。 推荐意见4:CCBs中毒时,若摄入时间在1~2h内,可行活性炭治疗;若活性炭无法及时使用可考虑洗胃,对于口服大剂量CCBs,洗胃应在摄入1h内进行,若存在胃排空延迟洗胃时间可适当延长至4~6h甚至更长时间。缓控释制剂中毒时可考虑全肠灌洗。 4.3 一线治疗 4.3.1 补液治疗 补液治疗是低血压或休克的传统治疗,在发生CCBs中毒时应被推荐为一线治疗[16],应根据补液的反应来滴定补液量,避免过量补液造成液体超负荷,若有条件可行有创或无创血流动力学监测对补液进行指导。 给药方案:先静脉输注10~20mL/kg晶体液10~15min,如果存在治疗反应则持续进行[16]。 推荐意见5:推荐在CCBs中毒引发低血压或休克时将补液作为一线治疗,应根据补液的反应来滴定补液量,避免过度补液。 4.3.2 血管活性药物 血管活性药物是临床治疗低血压和休克的常规方法。一项大型回顾性病例系列研究显示,主要使用血管加压药(最常见的是去甲肾上腺素,成人剂量高达100μg/min)的存活率极高,缺血并发症的发生率也很低[22]。在治疗严重的CCBs过量引起的低血压或休克时,可能需要大剂量,甚至使用多种血管加压药物和正性肌力药物[22]。应该注意的是不同休克类型选用不同的血管活性药物[21],去甲肾上腺素似乎是最适合用于CCBs过量患者的初始儿茶酚胺类药物[5]。 推荐意见6:推荐在CCBs中毒引发休克时使用血管活性药物作为一线治疗,一般首选去甲肾上腺素。 4.3.3 大剂量胰岛素(high-dose insulin, HDI) HDI主要依靠以下四种机制发挥作用[23]:① HDI通过心肌细胞中钙依赖性和非钙依赖性途径增加心输出量,这种心输出量的增加主要是由于每搏量的增加而不是心率的增加;②优化心肌能量利用,心肌胰岛素受体的饱和优化了细胞内葡萄糖用于ATP生产的可用性;③ HDI可改善CCBs中毒所致内分泌功能障碍和由此引起的高血糖;④通过增强内皮一氧化氮合酶发挥血管扩张作用,继而导致心输出量增加,并改善与心源性休克相关的微血管功能障碍。由此可见,HDI可用于治疗严重CCBs中毒引起的心源性休克[24]。 国外的一篇胰岛素治疗钙通道阻滞剂和β受体阻滞剂中毒的文献综述显示,在已发表的病例系列中观察到的成功率为80.4%~100%不等。在进行严密监测下,此疗法是安全的,可以考虑早期应用[25]。在连续12例登记病例中(除1例非CCBs中毒患者),HDI 治疗避免了血管加压药物的使用,有效逆转了药物性心源性休克,12例患者包括4例CCBs中毒患者[26]。回顾大剂量胰岛素在CCBs中毒中已发表的实验研究、病例报告和专家意见,基于可靠的作用机制、动物模型的良好有效性证据以及越来越多支持其安全性及有效性的已发表病例,建议一旦怀疑CCBs中毒患者出现心肌功能障碍,应尽早开始HDI治疗[27]。 值得注意的是,氨氯地平为二氢吡啶类CCBs,氨氯地平中毒主要以难以纠正的外周血管扩张性休克为主,除了钙通道阻滞的机理,氨氯地平与HDI一样,通过刺激内皮型一氧化氮合酶引起血管舒张[28-29]。因此,在氨氯地平中毒的情况下,HDI 理论上有可能引起协同的医源性血管舒张。所以在CCBs中毒的情况下,需要密切监测心脏功能状况,低剂量HDI可与去甲肾上腺素同时使用,若有心功能降低的证据,或是以心源性休克为主的混合型休克时再考虑上调胰岛素剂量[23]。 另有学者建议在CCBs中毒中,HDI不应优先于血管加压药物使用。CCBs中毒管理应结合患者具体情况,在适当的时候联合使用血管加压剂和HDI[30]。 大剂量胰岛素的用法[5,16]:胰岛素1U/kg的负荷剂量静脉注射,同时静脉注射0.5g/kg 葡萄糖(若血糖>16.7mmol/L则无需使用葡萄糖),然后胰岛素以0.5~1.0U/(kg∙h)持续静脉输注,根据需要静脉输注葡萄糖[ 起始剂量0.5g/(kg∙h)]维持血糖在正常范围(血糖:5~8mmol/L)。根据组织灌注情况可逐渐上调胰岛素用量,最大推荐剂量为10U/(kg∙h)。 不良反应主要包括低钾血症、低血糖及容量超载,建议在治疗过程中密切监测血糖、电解质,并根据具体情况进行出入量管理[24]。 推荐意见7:推荐在CCBs中毒引发心源性休克或以心源性休克为主的混合型休克时,使用大剂量胰岛素疗法。推荐与血管活性药物共同使用。治疗期间密切监测血糖、电解质和出入量。 4.3.4 静脉钙剂 静脉钙剂主要通过提高血液中钙离子浓度,增加细胞内外钙离子的浓度差来抵消钙通道阻滞带来的作用,增加钙离子内流。有研究显示钙剂在治疗CCBs中毒时改善了心率、血压和传导异常[31-32]。 目前建议剂量[16]: ① 10%氯化钙的给药方案:通常为每10~20min行10~20mL(1~2g)静脉注射或0.2~0.4mL/(kg∙h)[0.02~0.04g/(kg∙h)]静脉输注。 ② 10%葡萄糖酸钙给药方案:通常为每10~20min行30~60mL(3~6g)静脉注射或0.6~1.2mL/(kg∙h)[0.06~0.12g/(kg∙h)] 静脉输注。 特别注意:葡萄糖酸钙对于外周血管的刺激性较小,可通过外周或中心静脉给药,而氯化钙刺激性大,最好通过中心静脉导管进行输注。每1~2h 监测血清离子钙水平,警惕医源性高钙血症,血清离子钙目标值是正常范围的1.5~2.0倍[15,24]。在合并地高辛中毒时应避免使用钙剂[5]。 推荐意见8:建议在CCBs中毒时将静脉钙剂作为一线治疗。每1~2h监测血清离子钙水平,目标值是正常范围的1.5~2.0倍。 4.3.5 阿托品 阿托品通常作为心动过缓,包括CCBs中毒引发的心动过缓的一线治疗药物[33]。对于CCBs中毒患者,该疗法可能暂时有效,该药品容易获得,价格低廉,并且风险小,所以将它作为有症状性心动过缓或传导障碍时的一线用药推荐[16]。 用药方案为[5,16]:每3~5min进行0.5~1.0mg静脉注射。阿托品最大用量为3mg/d。 推荐意见9:建议在CCBs中毒引发有症状的缓慢型心律失常时应用阿托品作为一线治疗。 4.4 特殊疗法 为一线治疗无反应或特殊情境下的治疗方法。 4.4.1 静脉- 动脉体外膜肺氧合(venoarterial extracorporeal membrane oxygenation, VA-ECMO) CCBs中毒引起的难治性休克或心脏骤停是极为危重的临床情况。需要VA-ECMO支持治疗[16],它可以在心源性或混合型休克患者代谢外源性药物所需的时间内提供血流动力学和氧合支持。一项综述比较了及时接受体外生命支持的严重药物中毒患者的预后,结果显示生存率改善[34]。 虽然大多数CCBs中毒病例需要VA-ECMO来增加心输出量,但静脉- 静脉体外膜肺氧合(venovenous extracorporeal membrane oxygenation, VV-ECMO)可以用于严重的非心源性肺水肿或急性呼吸窘迫综合征[15]。 对2003-2018年的体外生命支持组织(Extracorporeal Life Support Organizations, ELSO)数据进行回顾,仅评估VAECMO对药物中毒继发心源性休克的治疗效果。其中有104例患者服用了20种不同的中毒药物,47.1%的患者服用了心血管药物,总体生存率为52.9%[35]。 近期发表的应用ECMO治疗单纯CCBs过量的回顾性分析显示[36],采用ECMO治疗CCBs过量患者出院的生存率为84.6%,ECMO平均时间4.3d,VA-ECMO和VV-ECMO 使用率分别为92.3%和7.7%。ECMO用于CCBs中毒的出院生存率明显高于ECMO用于其他治疗用途的生存率数据,提示CCBs过量的难治性心肺衰竭患者可以从ECMO支持中获益。 一项关于自杀性心血管药物过量继发心源性休克的单中心回顾性队列研究显示,患者在首次医学评估时脉压<35mmHg,到达ICU时左室射血分数<20%,都提示可能需要体外生命支持[37]。 推荐意见10:建议在CCBs中毒引起的难治性休克或心脏骤停时,可将VA-ECMO作为体外生命支持治疗的选择。 4.4.2 临时起搏治疗 一些病例报告描述了对CCBs中毒后出现缓慢型心律失常和血流动力学不稳定的患者使用临时起搏的情况,结果并不完全一致[22-33,38]。临时起搏对于血流动力学不稳定的缓慢型心律失常的患者可能是合理的,但并不总是有效,尤其是在房室结完全阻滞或血管扩张性休克的患者中[33]。 推荐意见11:CCBs中毒所致伴血流动力学不稳定的缓慢型心律失常时,可尝试临时起搏治疗。 4.4.3 静脉脂肪乳疗法 中毒时使用静脉脂肪乳(intravenous lipid emulsion, ILE)的作用机制:将亲脂性药物从中毒部位转移,并为心肌提供游离脂肪酸作为能量来源[39]。ILE通过降低血清游离药物浓度来发挥作用。静脉注射脂肪乳剂通过在血浆中形成一个富脂区,将亲脂性药物与靶组织分离开来。另一种理论认为,ILE通过高剂量的游离脂肪酸激活心肌细胞中的电压门控钙通道为心肌提供能量[40]。 病例系列和病例报告提示脂肪乳可能有助于血流动力学的改善[41–44],可用于一线治疗效果不佳的CCBs中毒患者[16]。 常用剂量及用法[5,16,45] :20%脂肪乳剂1.5mL/kg,1min内静脉注射,根据需要重复两次,直到达到临床稳定,然后静脉输注0.25mL/(kg∙min),持续30~60min。美国食品和药物管理局规定,每24h给药的最大总剂量为12.5mL/kg。 然而,一项大型回顾性研究未发现ILE疗法对CCBs中毒的益处[46],且实验和临床数据表明,ILE会增加胃肠道对亲脂性药物的吸收,可能会加重口服药物的中毒[47-48]。不良反应包括高脂血症对血液化验的干扰、诱发胰腺炎、对血液净化和ECMO管路可能产生的不良影响[49]。 推荐意见12:不推荐在CCBs中毒时常规使用静脉脂肪乳。但在其他治疗方法无效或不可获得时,可考虑尝试使用。 4.4.4 亚甲蓝 亚甲蓝是一氧化氮和环磷酸鸟苷介导的血管舒张抑制剂,可能以非儿茶酚胺依赖的方式提供治疗益处。亚甲蓝治疗休克的作用机制是通过抑制一氧化氮途径中的鸟苷酸环化酶减少血管舒张[50]。血管扩张性休克的剂量通常为1~2mg/kg,5min内静脉注射,然后持续静脉输注1mg/(kg∙h)。最大剂量为7mg/kg[15]。亚甲蓝在病例系列和病例报告中被描述为治疗CCBs药物过量(主要涉及氨氯地平)后难治性血管扩张性休克的有效辅助药物[50]。亚甲蓝作为辅助血管加压剂治疗CCBs中毒的应用仅得到轶事证据的支持,并且应仅在其他治疗无反应的难治性血管扩张性休克的病例中考虑,或作为过渡到机械循环支持的临时措施,在围心脏停搏期患者不考虑应用[15]。 推荐意见13:在CCBs中毒引起的其他一线治疗无反应的难治性血管扩张性休克的病例中,可以尝试使用亚甲蓝。 4.4.5 血液净化治疗 CCBs药代动力学特点:CCBs多吸收良好,小分子物质,蛋白结合率高,分布广泛,在肝脏中被广泛代谢。CCBs被认为是不可透析的,其内源性清除率高,超过400mL/min,无论何种体外清除方式,目前的药代动力学和毒代动力学数据表明,体外清除最多能使总清除率提高5%~10%[51]。虽然中毒体外治疗工作组推荐意见:不建议在严重中毒患者中使用体外方法来加强氨氯地平、地尔硫䓬和维拉帕米的清除[51]。但在一些特定情况下如严重低血压、休克、围心脏骤停、甚至心脏骤停等组织灌注严重不良和严重肝肾脏器功能衰竭的情况时,内源性清除能力将受到严重影响,血液净化可能成为主要甚至唯一的清除方式。此时血液净化对CCBs清除可能存在重要意义。目前严重CCBs中毒的血液净化治疗多见于重症患者合并急性肾功能衰竭时的容量管理和肾替代治疗。但在严重CCBs中毒特别是合并其他药物混合中毒的情况下,很多案例报道和临床观察在多种治疗方法同时采用了血液灌流或血浆置换、白蛋白透析、分子吸附再循环(MARS)等体外清除方式,临床结局良好[4,52-54]。 推荐意见14:在严重CCBs中毒存在严重灌注不良或存在肝肾脏器功能衰竭时,可行血液净化治疗,作为药物治疗的补充,应选择理论上对蛋白结合率高的药物有清除作用的血液净化方式增加CCBs的清除,如血浆置换或血液灌流等。合并急性肾功能衰竭时应同时选择肾脏替代治疗。 钙通道阻滞剂中毒药物推荐剂量及注意事项见表1,钙通道阻滞剂中毒急诊诊治流程图见图1。大剂量或重度CCBs中毒患者病死率高,往往需要联合多种治疗手段进行救治。目前有关CCBs中毒相关推荐意见的证据级别低,需要进一步的临床研究和试验来验证每个治疗方法的效果、安全性以及确定理想的治疗剂量范围。本共识仅为临床诊断、评估、治疗提供参考,临床实践中仍应结合当地的医疗条件和患者的具体情况来选择合适的诊断和治疗方案。
执笔人:李辉、郭治国、郑思骞 共识制定专家组成员(按姓名拼音排序):艾芬(武汉市中心医院);安莹波(北京市海淀医院);曹钰(四川大学华西医院);车在前(上海交通大学医学院附属瑞金医院);陈凤英(内蒙古医科大学附属医院);陈辉(北京市急救中心);陈怡(上海交大附属仁济医院);崇巍(中国医科大学附属第一医院);代传扬(贵州医科大学附属医院);窦清理(深圳宝安人民医院);杜俊凯(西安交通大学医学院第一附属医院);冯杰(山西医科大学第一医院);付源伟(北京大学第三医院);高恒波(河北医科大学第二医院);葛洪霞(北京大学第三医院);谷士贤(北京大学第三医院);关键[ 北京华信医院(清华大学第一附属医院)] ;管军(上海长征医院);郭伟(首都医科大学附属北京中医医院);郭杨(北京大学人民医院);郭治国(北京大学第三医院);韩彤妍(北京大学第三医院);何小军(《中华急诊医学杂志》编辑部);何新华(首都医科大学附属北京朝阳医院);洪玉才(浙江大学医学院附属邵逸夫医院);胡佳文(上海同济大学医学院附属医院上海第一人民医院);贾春梅(沧州市中心医院);姜冰玉(甘肃省第三人民医院);蒋丽(大连医科大学附属第一医院);兰超(郑州大学第一附属医院);李彩霞(山西省人民医院);李斗(北京急救中心);李杰(首都医科大学附属复兴医院);李俊红(首都医科大学附属北京佑安医院);李连祥(山东第一医科大学第二附属医院);李硕(北京大学第三医院);李素彦(河北省人民医院);李欣(广东省人民医院);李岩(上海市第四人民医院);李燕(山西医科大学第二医院);李颖(北京市大兴区人民医院);梁璐(河北大学附属医院);林珮仪(广州医科大学附属第二医院);刘德红(深圳市第二人民医院);刘继海(中国医学科学院中国协和医科大学北京协和医院);刘笑然(海南医学院第一附属医院);逯林欣(山西大医院);罗凌青(海南医学院第一附属医院);吕菁君(武汉大学人民医院);马剡芳(首都医科大学附属北京地坛医院);孟新科(深圳市第二人民医院);米玉红(首都医科大学附属北京市安贞医院);宁玉珍(内蒙古医科大学附属医院);潘龙飞(西安交通大学第二附属医院);裴红红(西安交通大学医学院第二附属医院);裴俏(《中国急救医学》杂志编辑部);钱欣(福建省立医院);秦延军(河北医科大学第三医院);秦宇红(北京大学国际医院);曲芸(青岛大学医学院附属烟台毓璜顶医院);邵菲(首都医科大学附属北京朝阳医院);史菲(暨南大学第二临床医学院深圳市人民医院);史继学(山东第一医科大学第二附属医院);司君利[ 山东省青岛市立医院(东院区)] ;宋晓健(山西省心血管病医院);宋振举(复旦大学附属中山医院);苏立军(淄博市中心医院);唐存亮(包头医学院第二附属医院);唐永军(赤峰学院附属医院);唐泽海(华中科技大学同济医学院附属协和医院);唐子人(首都医科大学附属北京朝阳医院);田慈(北京大学第三医院);万智(四川大学华西医院);王聪(北京积水潭医院);王国栋(北京大学第三医院延庆院区);王国兴(首都医科大学附属北京友谊医院);王海嵘(上海交通大学医学院附属新华医院);王晶(首都医科大学宣武医院);王力军(天津大学总医院);王晓梅(四川省人民医院);王鑫(邯郸市中心医院);王旭东(北京大学航天中心医院);王英俊(大连广济颈肩腰腿痛医院);王映珍(兰州大学第二附属医院);王玉玲(新疆医科大学第一附属医院);王子超(包头医学院第二附属医院);温伟(北京医院);吴彩军(北京中医药大学东直门医院);吴永华(北京大学第三医院);咸会波(青岛市市立医院);向旭东(中南大学湘雅二院);邢吉红(吉林大学白求恩第一医院);熊辉(北京大学第一医院);徐玢(首都医科大学附属北京天坛医院);徐定华(北京大学第三医院);燕宪亮(徐州医科大学附属医院);杨军(枣庄市立医院);杨丽(北京大学第三医院);杨蓉佳(甘肃省人民医院);杨毅恒(北京大学第三医院);余涛(中山大学附属第二医院);詹红(中山大学附属第一医院);张斌(青海省人民医院);张海钢[ 深圳市第六人民医院(南山医院)];张海燕(北京市顺义区医院);张红(北京大学第一医院);张红(首都医科大学石景山教学医院北京市石景山医院);张洪波(卫生部中日友好医院);张剑锋(广西医科大学第二附属医院);张金英(滨医附院);张静(首都医科大学附属北京胸科医院);张娟(中南大学湘雅医院);张祺(北京大学第三医院);张向阳(北京清华长庚医院);张新颜(北京市海淀医院);张蕴(首都医科大学附属北京同仁医院);赵红梅(淮安市第一人民医院);赵赞梅(北京大学第三医院);郑亦沐(北京大学第三医院);郑悦亮(浙江省人民医院);周敏杰(上海交通大学医学院附属上海市第六人民医院);周启棣(北京大学深圳医院);周彤(包钢医院);周轶(山东省立医院) 利益冲突 所有作者声明无利益冲突 参考文献(略) 文章来自:中华医学会急诊医学分会,中国医药教育协会急诊医学专业委员会.钙通道阻滞剂中毒急诊诊治专家共识[J].中华急诊医学杂志,2025,34(3):318-325. (责任编辑:admin) |