|
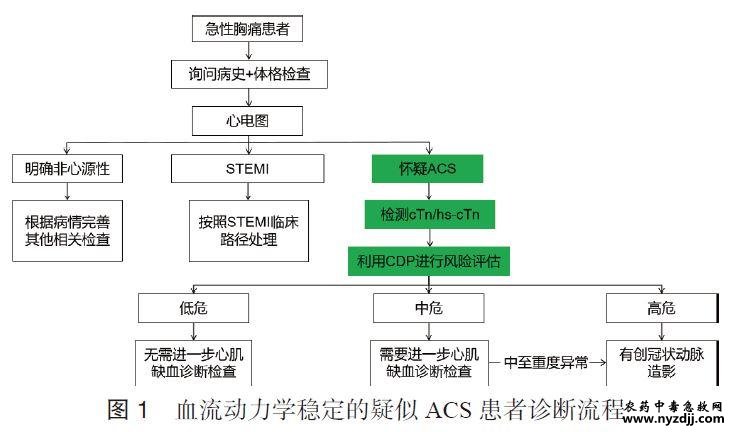
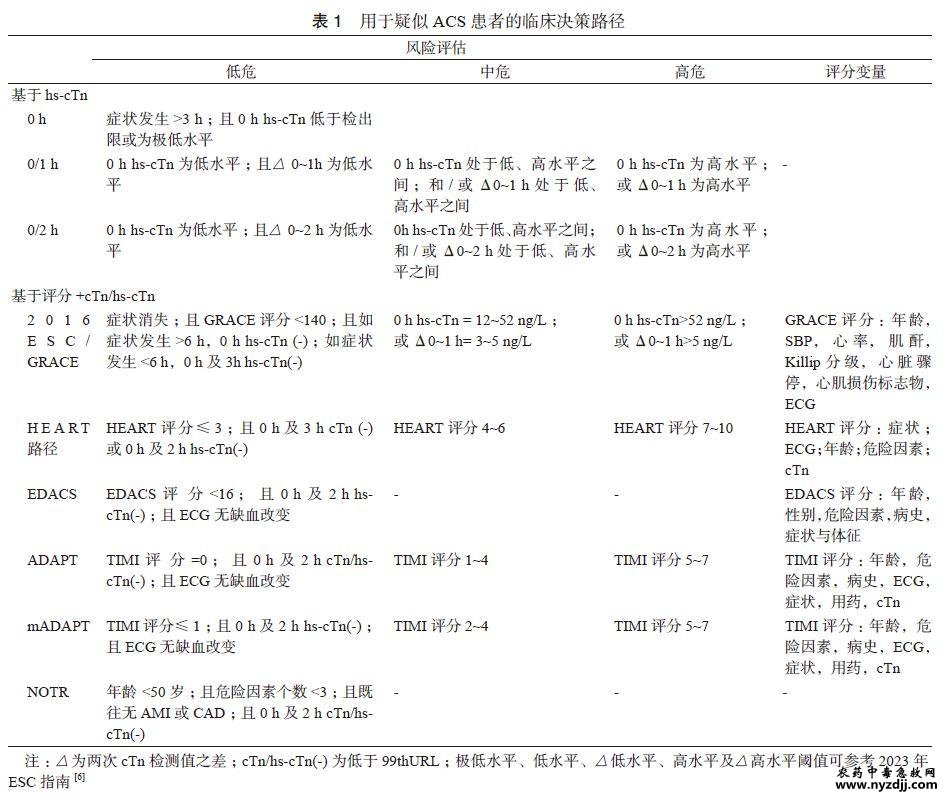
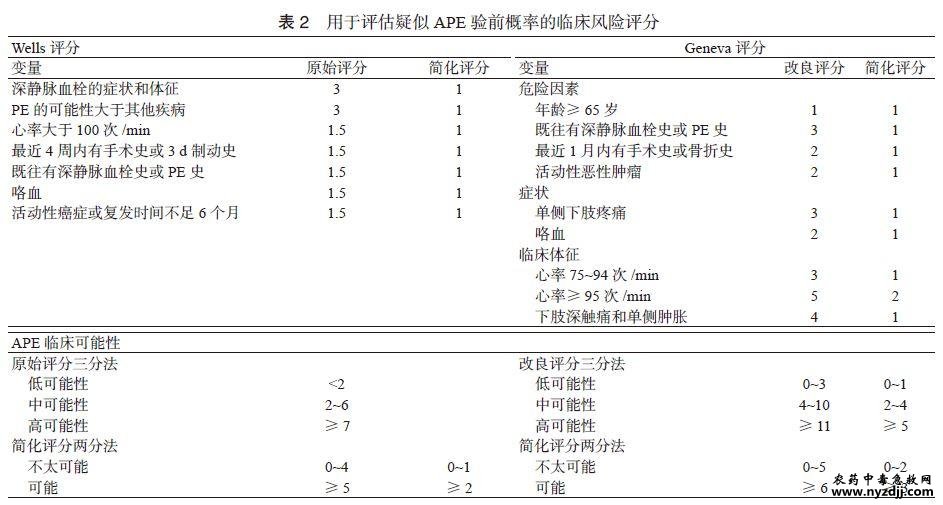
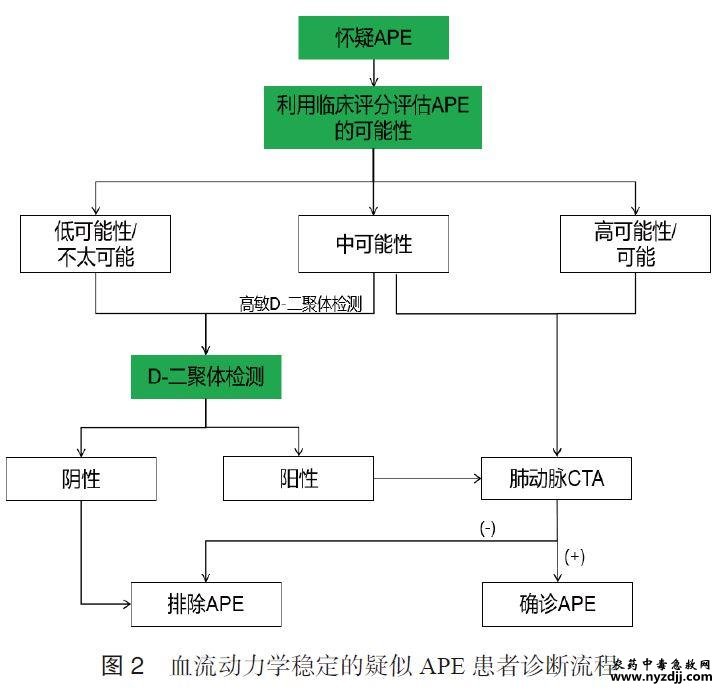
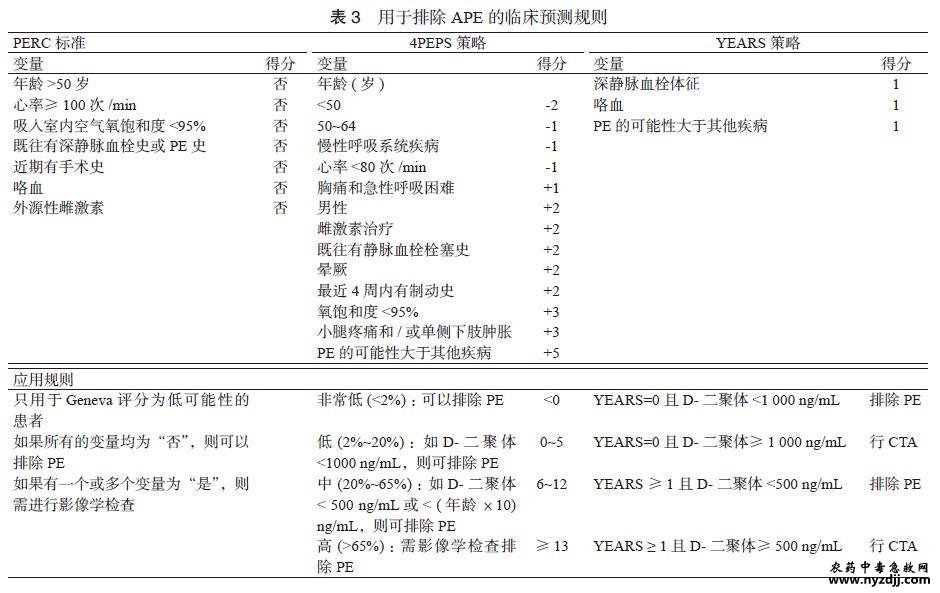
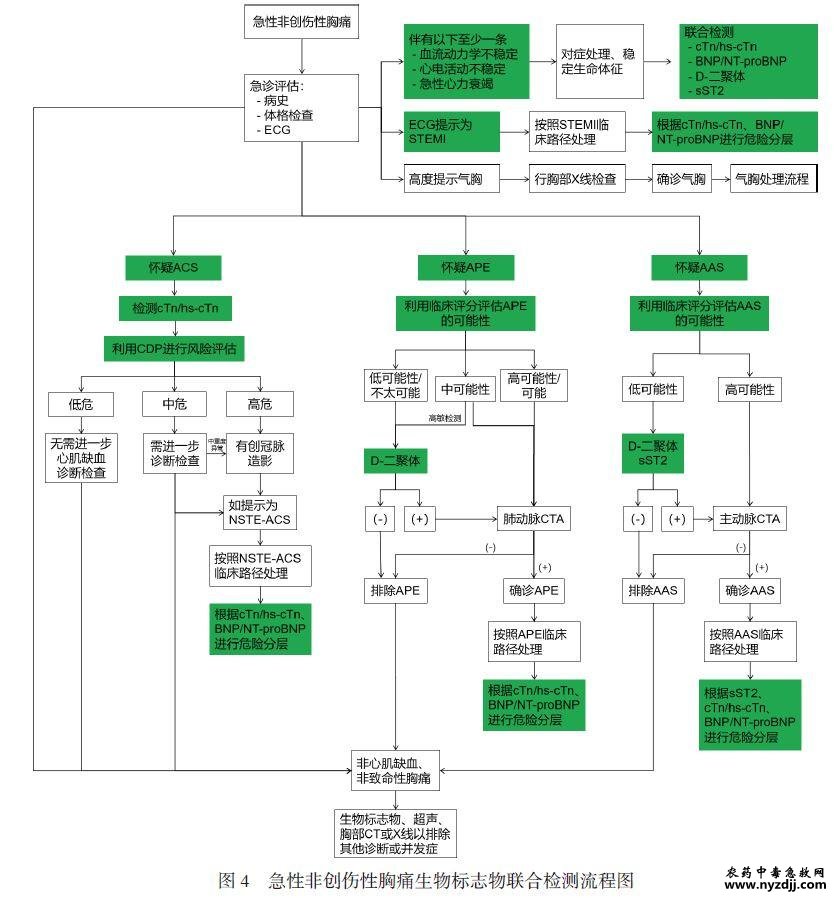
急性胸痛是急诊科最常见的就诊症状之一,病因复杂、风险悬殊。多种致命性心血管急症,如急性冠脉综合征(acute coronary syndrome,ACS)、急性肺栓塞(acute pulmonary embolism,APE)、急性主动脉综合征(acute aortic syndrome,AAS)等,常以急性胸痛为主要症状被送至急诊科进行诊断与治疗。但并非所有胸痛都属于高危类型,相当比例的患者预后良好,如肋间神经痛等,不需要进行过多检查和监测。因此,做好急性胸痛的急诊评估与管理,准确识别高危胸痛并快速处理、避免低危胸痛过度诊疗,对维护人民健康、降低医疗负担具有重大意义。近年来,生物标志物联合检测在急性非创伤性胸痛的诊断中发挥了重要作用。我国急诊医学和心血管病学等领域专家在2015年发布的《急性非创伤性胸痛生物标志物联合检测专家共识》[1]中,系统阐述了多种生物标志物在急性胸痛评估与诊断中的应用价值和方法,极大地推动了国内该领域临床实践的进步。 随着生物标志物研究的快速进展,新的检测技术和临床应用证据不断涌现,为了满足临床工作需要并进一步规范急性胸痛的评估和管理,中国医师协会胸痛专业委员会、中国医疗保健国际交流促进会胸痛学分会及中华急诊医学杂志编辑委员会组织国内急诊、心血管及检验等领域专家,结合最新文献、指南及临床实践,对2015年共识进行了补充和更新。更新的主要内容包括:⑴提出明确的专家推荐意见,以提高临床可操作性;⑵强调生物标志物检测及联合检测在临床决策路径中的重要作用,并提供相应图表指导具体应用;⑶增加急性胸痛相关新型生物标志物的介绍和应用证据,为临床和科研工作提供更全面的诊断和评估工具。 本共识的制定步骤及方法:⑴成立共识工作组,包括指导组、专家组、方法学组及秘书组;⑵通过检索PubMed、MEDLINE、Embase、Cochrane、中国知网、万方医学网和中国生物医学文献数据库等进行文献检索;⑶由共识方法学组进行文献筛查和文献阅读,纳入急性胸痛生物标志物检测相关文献,并对纳入文献进行质量评价及汇总;⑷采用会议法,结合文献中的循证医学证据、共识专家组的临床经验以及我国国情,通过会议形式,反复讨论、修改,总结得出一致性程度较高的推荐意见,最终形成本共识。本共识通过国际实践指南注册与透明化平台(Practice guideline REegistration for transPAREncy,PREPARE)进行注册(注册号:PREPARE-2024CN885)。 1 背景 在临床工作中,“胸痛”一词不仅指胸部疼痛,还包含胸闷、憋喘、心悸、压迫感、烧灼感、紧缩感等多种胸部不适感,以及怀疑是心源性胸痛时胸部以外其他部位的不适感,包括下颌、颈部、肩部、上肢、背部或上腹部等。当胸痛为新发或胸痛的性质、强度、持续时间等发生变化时,应考虑为急性胸痛。本共识仅讨论由非创伤性原因引起的急性胸痛,即急性非创伤性胸痛。全面的胸痛问诊可为早期快速诊断提供重要线索[2],问诊要素包括但不限于:胸痛部位、性质、强度、发作和持续时间、放射痛、诱发因素、缓解因素、伴随症状等[3]。 但胸痛症状的强度与疾病的严重程度并不总是呈平行关系,且不同病因也可引起相似的胸痛症状[3]。 所有急诊接诊的急性非创伤性胸痛患者,均应进行病史采集、体格检查及心电图(electrocardiogram,ECG)检查(首次医疗接触10min内,18导联)。综合临床信息后,高效且有针对性地使用生物标志物检测,有助于及时作出正确的诊断和治疗决策[4-5]。标志物的检测和结果解释必须以临床情况为指导,并对当前的循证证据有充分的认识。 危及生命的高危胸痛包括但不限于ACS、APE、AAS等。由于ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)可通过首次ECG迅速识别,急性胸痛诊断的主要挑战是快速诊断和排除非ST段抬高型急性冠脉综合征(non-ST-segment elevation acute coronary syndrome,NSTE-ACS)、AAS、APE等致命性高危胸痛,生物标志物在此方面具有显著优势。 推荐意见1:胸痛不仅指胸部范围内的疼痛,还包括多种胸部不适感以及胸部以外其他部位的不适感(怀疑是心源性胸痛时);当胸痛为新发或性质、强度、持续时间等改变时,应视为急性胸痛。 推荐意见2:结合全面问诊、ECG和体格检查,高效且有针对性地使用生物标志物联合检测,有助于及时作出正确的诊断和治疗决策。 2 生物标志物 2.1 心肌肌钙蛋白 2.1.1 在急性冠脉综合征中的应用 对急性胸痛患者评估的关键任务之一是快速识别和治疗急性心肌梗死(acute myocardial infarction,AMI),且诊断方法的灵敏度和阴性预测值(negative predictive value,NPV)要超过99%。同时也应在保证安全性的前提下提高低危患者的识别率,即对非ACS且不良事件发生率低的患者进行有效排除[3]。在排除提示STEMI 或高危NSTE-ACS的临床和ECG征象后,生物标志物在疑似ACS患者的诊断、风险分层和管理中发挥重要作用[6]。其中,心肌肌钙蛋白(cardiac troponin,cTn)是心肌细胞损伤特异性标志物,针对cTn的检测方法越来越灵敏,尤其是高敏cTn(high-sensitivity cardiac troponin,hs-cTn)在临床实践中得到广泛应用,提高了急性胸痛评估的高效性和安全性。同时,由于非心肌缺血性cTn升高检出率的显著增加,临床上需考虑和评估的情况也变得更加复杂[7]。cTn的生理及代谢特点、hs-cTn的判断标准见2015版共识[1]。 自2011年以来,欧洲心脏病学会(European Society of Cardiology,ESC) ACS指南中,对hs-cTn使用的推荐均为I类,并提供了用于风险分层的特定阈值[6, 8-10]。2023年ESC指南建议采用0/1 h和0/2 h的AMI早期排除算法,并给出了Ⅰ类推荐、B级证据[6]。2021年美国心脏协会(American Heart Association,AHA)/美国心脏病学会(American College of Cardiology,ACC)等多学会联合发布的胸痛评估和诊断指南也针对此问题提出多项建议,包括将hs-cTn作为首选生物标志物,建议测定值升高为高于表观健康人第99百分位值,即99th 参考值上限(upper reference limit,URL),建议使用临床决策路径(clinical decision pathways,CDP)进行结构化评估管理等[3]。该指南也指出应考虑99th URL存在性别差异。有多项研究表明,女性hs-cTn 的99th URL低于男性,使用性别特异的参考值可降低女性AMI的漏诊率[11-13]。正在进行的随机对照试验试图探索性别特异的hs-cTn阈值对女性胸痛患者结局的影响,结果值得期待[14]。 2.1.1.1 单次基线检测 对于胸痛症状发作超过3h后到达急诊的患者,单次基线hs-cTn为极低水平值(如低于检出限)基本上可排除AMI[15-19],该类患者发生短期和长期主要不良心血管事件(major adverse cardiovascular events,MACEs)概率低[20-21]。2021年AHA/ACC胸痛指南指出,对于到达急诊时症状已出现3h以上,怀疑为ACS且ECG正常的患者,单次基线hs-cTn低于检出限可基本排除心肌损伤(Ⅱa类推荐,B-NR级证据)[3]。 2.1.1.2 动态监测 动态监测hs-cTn变化对于诊断/排除AMI以及急性胸痛危险分层来说有重要价值[3, 6, 22]。基线hscTn无升高(<99th URL), 后续检测也无升高,有助于进一步提高排除AMI的可靠性;如后续检测cTn升高(>99th URL),则会提高识别高危患者的准确性[23-25]。当基线hscTn升高,如动态监测出现显著的上升或下降(>20%),提示存在急性心肌损伤;如无显著变化则为慢性心肌损伤。由于hs-cTn检测敏感性的提升,越来越多的慢性心肌损伤被检测出来,应强调通过动态监测来鉴别急、慢性心肌损伤,并结合患者是否存在心肌缺血临床表现,提高诊断/排除AMI的准确性[22, 26]。 2.1.1.3 临床决策路径 基于动态监测hs-cTn(0/1h,0/2h,0/3h)的结构化CDP,可在可疑ACS患者就诊1~3h内完成风险评估,将患者分为高、中、低危三组。高危组(诊断ACS或发生MACEs的可能性高),应尽快给予心导管检查和救治;中危组,应积极观察、完善进一步的评估后再决定如何分流;低危组,通常无需进一步心肌缺血相关诊断检查(表1,图1)[3, 6]。研究表明,有40%~60%的患者在就诊后1~2h内即可确定为低风险人群而直接离院[3, 27-28]。然而,高质量观察性研究表明,仅依靠hs-cTn而不进行临床评估可能会导致部分风险较高的患者被误判为低危并直接离院[29]。因此,临床评估不可忽视,不能单独依赖hs-cTn来指导患者的分流决策[28]。 将cTn与临床评分相结合的CDP有助于风险分层和分流决策[3]。尤其是使用普通cTn检测时,因其诊断时效性、准确性较hs-cTn弱,更应结合临床评分来提高风险评估的准确性。临床评分是量化患者已发生ACS或30d内发生MACEs概率的综合性评估工具,结合了年龄、冠心病危险因素、症状、ECG及cTn等临床信息,包括GRACE、HEART、TIMI、EDACS、EMPACT等多种评分方法[9, 30-35]。结合评分的CDP同样可将患者分层为高、中、低危三组,具体划分标准详见表1。其中,低危组的定义明确且灵敏度高,用于排除AMI、识别低危患者安全性好;但对中危和高危组的定义尚不十分确切,还需更多高质量循证证据支持[22,36-38]。 2021年AHA/ACC胸痛指南推荐对急性胸痛和疑似ACS的患者使用CDP进行风险评估,将患者分为低、中、高危,以促进分流和随后的诊断评估(Ⅰ类推荐,B-NR级证据)[3]。通常,cTn有cTnI和cTnT两种类型,检测手段有高敏、普通之分,检测形式包括实验室检测和即时检测。基于不同的cTn检测和评分,现有多个CDP可供选择。因此,建议根据本单位的具体情况选择适用的cTn检测方法和CDP开展临床工作,以有利于单位内这类患者评估和临床决策的规范性和一致性。 2.1.1.4 鉴别诊断与预后评估 cTn升高反映心肌细胞存在损伤,具有心肌组织特异性,但并不具有病因特异性。导致cTn释放入血的原因有很多种,包括心肌细胞的正常代谢、细胞壁通透性增加以及各种原因引起的心肌细胞坏死等。因此,cTn升高时,除考虑AMI外,还应考虑其他病因的可能性,进行针对性的评估和排除,包括贫血、低氧、低血压/休克、心律失常(室性心动过速、室上性心动过速、心动过缓)、冠状动脉或心脏手术、严重高血压伴或不伴左室肥厚、心肌炎、心肌病、Takotsubo综合征、心力衰竭(以下简称心衰)、肺栓塞、肺动脉高压、肾功能不全、脓毒症、脑卒中、蛛网膜下腔出血、淀粉样变性、化疗药物、靶向药物、免疫治疗、放射治疗、剧烈运动、外伤、电击伤等[22]。 尽管区分这些心肌损伤的原因非常具有挑战性,但无论最终诊断如何,心肌损伤的存在均与胸痛患者不良结局的高风险相关[3, 39]。 初始cTn水平升高与ACS患者短期和长期死亡风险有关。有研究提示,hs-cTnT和hs-cTnI 对于诊断1型及2型AMI具有相似的准确性,但hs-cTnT与预后的相关性强于hs-cTnI[40-42]。动态监测可确定AMI患者的cTn峰值水平,用于风险分层;hs-cTn水平越高,死亡风险越大;但动态监测的最佳时间点尚不明确[6]。 2.1.2 在急性肺栓塞中的应用 cTn升高与APE急性期预后不良和死亡风险增加有关。在APE患者中,约30%~60%出现cTn/hs-cTn升高。APE的救治策略选择基于对栓塞严重程度和早期死亡风险的评估,低、中、高风险组需采用不同的治疗方案,cTn是否升高是评估患者风险的重要指标之一[43]。对于cTn显著升高且伴有右心功能不全的高风险患者,可能需要采取溶栓等积极治疗措施。同时,治疗过程中cTn水平的变化有助于评估治疗效果和心肌损伤的恢复情况。 2.1.3 在急性心力衰竭中的应用 急性心衰常合并不同程度的cTn升高,cTn对心衰的鉴别诊断、危险分层及预后评估具有重要价值。急性心衰与ACS常合并出现,部分患者中ACS是急性心衰的诱因。与单纯ACS相比,这两种病症并存与更高的短期死亡率相关。急性心衰患者的cTn升高也可能与心肌缺血无关,反映短暂性或局限性的心肌损伤[44]。有研究显示,急性心衰患者cTn升高的检出率为17%~75%,而使用hs-cTn检测时检出率超过90%;cTn/hscTn水平升高是急性心衰患者发生院内不良事件的独立预测因素,并与出院后短期和长期不良预后相关[45]。 2.2 其他心肌损伤标志物 对于临床上常用的其他心肌损伤标志物,如心梗三项中的肌酸激酶同工酶(creatine kinase-MB,CK-MB)和肌红蛋白(myoglobin,Myo),多项研究已证实其在AMI的诊断和预后评估方面不如cTn[46-48]。在cTn基础上增加CK-MB或Myo的检测,可能并不能为胸痛患者带来更多益处。2021年AHA/ACC胸痛指南指出,当cTn可以检测时,不推荐常规使用CK-MB和Myo来诊断急性心肌损伤[Ⅲ类推荐(无益),B-NR 级证据][3]。2023年ESC ACS指南强调使用cTn来诊断ACS[6]。国内多项专家共识也明确表示,对于可疑ACS患者应测定cTn(首选hs-cTn),其灵敏度和特异度显著优于其他传统生物标志物[5, 7, 49-50]。 推荐意见3:针对怀疑为ACS的急性胸痛患者,应将hs-cTn作为首选生物标志物,检测值高于99th URL定义为心肌损伤(注意存在性别差异);建议使用适用于本单位的cTn检测方法和CDP对患者进行结构化风险评估和分流。 推荐意见4:动态监测cTn可用于鉴别急性及慢性心肌损伤,并需考虑除AMI外可引起cTn 升高的其他诊断;建议在危重患者中检测cTn水平,以明确是否存在心肌损伤及程度,完善短期及长期预后评估。 2.3 D-二聚体 D-二聚体是交联纤维蛋白的降解产物,反映血浆中凝血系统和纤溶系统的激活,急性血栓形成时血浆中D-二聚体水平升高[51]。高敏D-二聚体检测的阴性预测值(NPV)和灵敏度均较高,对于排除APE和AAS意义较大,但阳性预测值(positive predictive value,PPV)和特异度均较低,在肿瘤、严重感染或炎症性疾病、妊娠期等情况下也会出现升高,因此用于明确诊断的效能较差。 2 .3.1 在急性肺栓塞中的应用 对于急诊疑似APE的患者,肺动脉CT血管造影(computed tomography angiography,CTA)是诊断APE的金标准[43, 52-53]。在保证安全性的前提下,使用临床预测规则来选择合适的患者进行CTA检查有助于减少患者暴露于造影剂过敏、肾损伤和累积辐射诱发癌症的风险[54]。2021年AHA/ACC胸痛指南推荐,对于可疑APE的胸痛患者,应在影像学检查前通过临床预测规则评估其APE的概率(临床验前概率,clinical pretest probability,CPP)以指导开展进一步的诊断性检查(Ⅰ类推荐,C-EO级证据)[3]。 临床预测规则包含两个步骤:临床风险评分和D-二聚体检测。最常用的临床风险评分是Wells和Geneva评分(表2)。高敏D-二聚体检测目前被认为是诊断静脉血栓栓塞患者的生化金标准[55]。在血流动力学稳定的疑似APE患者中,临床评分根据发生APE的可能性(CPP)将患者进行分组,有三分法(低、中、高可能性)和两分法(不太可能、可能)两种。2019 年ESC APE 诊断和管理指南推荐,评分为“低”(三分法)或“不太可能”(两分法)的患者,如D-二聚体结果为阴性(<500ng/mL),则认为患者可排除APE,无需进行进一步的检查;如D-二聚体结果为阳性(>500ng/mL),则要进行影像学检查。评分为“中”(三分法)的患者可采用高敏方法来检测D-二聚体,以辅助分流决策;但若本单位采用的D-二聚体检测方式为非高敏,则无需检测D-二聚体,直接进行影像学检查[43]。对于被评为“高”或“可能”的患者,因D-二聚体假阴性和假阳性率较高,对临床决策没有帮助,可不用检测,直接进行影像学检查(图2)[43,56]。
需要注意的是,尽管D-二聚体检测简单经济、敏感度高,但因特异度较差,常在低风险患者中出现假阳性结果。为解决这一问题,多个新的临床预测规则被探索和开发,包括肺栓塞排除标准(Pulmonary Embolism Rule Out Criteria,PERC)、四级肺栓塞临床概率评分(4-Level Pulmonary Embolism Clinical Probability Score,4PEPS)、YEARS 策略和肺栓塞分级D- 二聚体(Pulmonary Embolism Graduated D-Dimer,PEGeD)策略(见表3)[52, 57-59]。PERC仅包含临床变量,无需检测D-二聚体,但仅适用于已被Geneva评分分类为低风险的患者。4PEPS评分、YEARS策略和PEGeD策略则根据不同的CPP水平,应用了不同的D-二聚体临界值来判断D-二聚体是否为阳性[53]。2019年ESC APE指南推荐,可以考虑使用与CPP相匹配的D-二聚体临界值来排除APE(IIa类推荐,B级证据)[43]。
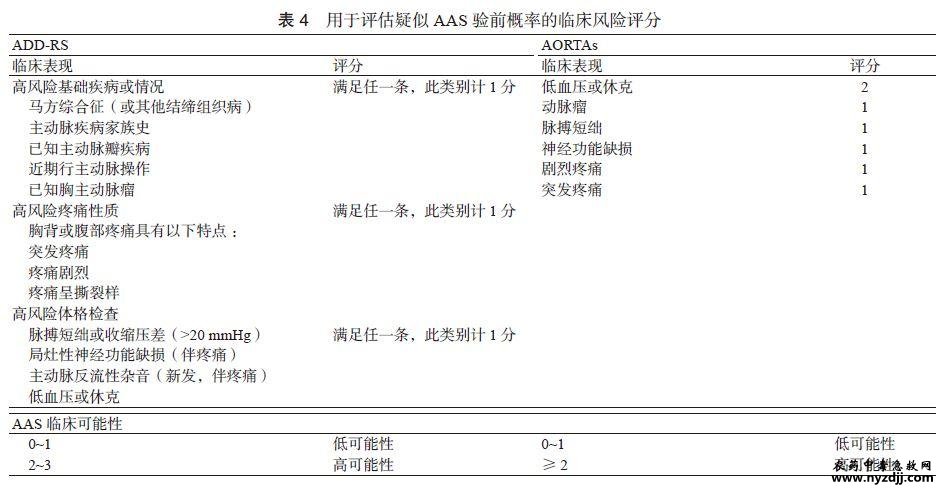
D-二聚体在APE中的诊断特异度随着年龄的增长而下降,这可能与老年人普遍存在的轻度促炎状态有关[60-61]。研究显示,CPP结合年龄调整的D-二聚体临界值( >50岁时,年龄×10ng/mL),与结合固定临界值(<500ng/mL)相比,在不增加假阴性率的基础上,识别出可安全离院的低危患者的数量增加了5倍(从6.4%增加到30%)[62]。2019年ESC APE指南建议使用年龄调整的D-二聚体临界值(>50岁时,年龄×10ng/mL)排除APE(Ⅱa类推荐,B级证据)[43]。 2.3.2 在急性主动脉综合征中的应用 AAS病情进展迅速、病死率高,因病变血管累及范围不同,临床表现常复杂多变,误诊漏诊和过度检查都较为常见。AAS主要包括主动脉夹层(aortic dissection,AD)、主动脉壁内血肿(intramural hematoma,IMH)和主动脉穿透性溃疡(penetrating aortic ulcer,PAU),这三种类型均有导致主动脉破裂的风险[63]。 2022年ACC/AHA主动脉疾病诊断与管理指南指出,目前尚无生物标志物可以用于诊断AAS,但在血流动力学稳定且AAS临床可能性较低的患者中,D-二聚体阴性(<500ng/mL)有助于排除AAS ;可借助风险评分系统,如主动脉夹层风险评分(aortic dissection detection-risk score,ADD-RS) 或主动脉简化评分(aorta simplifi ed score,AORTAs)对可疑AAS患者的CPP进行评估(表4)[64]。
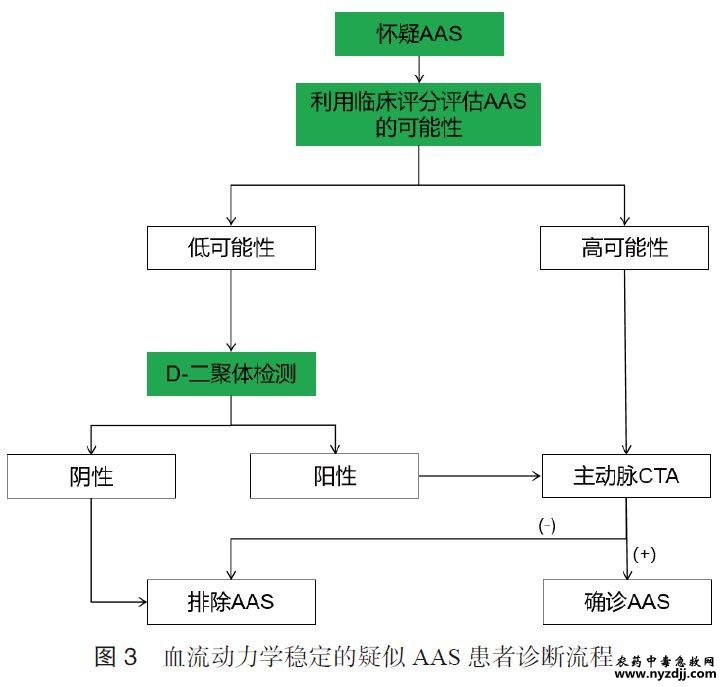
2024年ESC主动脉疾病管理指南中,推荐使用结合A DDRS和D-二聚体的多参数诊断算法来排除或诊断AAS(Ⅰ类推荐,B级证据)[65]。该算法已被证实具有较高的排除AAS的能力[66-67]。 根据AAS高危病史、疼痛性质和体征,使用A DD-RS可将疑似AAS患者分为两个不同的临床可能性(即CPP)等级,ADD-RS≤1分为低可能性,2~3分为高可能性。在低可能性患者中,D-二聚体阴性(<500ng/mL),有助于排除AAS,而D-二聚体阳性则建议行CTA检查;对于高可能性或者血流动力学不稳定的患者,D-二聚体诊断价值低,应直接进行影像学检查(图3)[66, 68]。
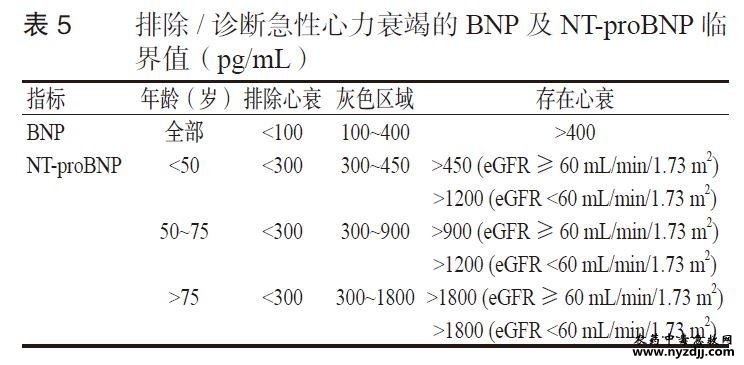
推荐意见5:D-二聚体在排除APE方面具有重要意义,但其诊断效能较差。对于血流动力学稳定的可疑APE患者,建议先通过临床评分评估APE的可能性大小,低中可能性患者再进行D-二聚体检测,如阴性则有助于排除APE,如阳性则需行肺动脉CTA检查。 推荐意见6:D-二聚体在排除AAS方面具有重要意义,但其诊断效能较差。对于血流动力学稳定的可疑AAS患者,建议先通过临床评分评估AAS的可能性大小,低可能性患者再进行D-二聚体检测,如阴性则有助于排除AAS,如阳性则需行主动脉CTA检查。 2.4 可溶性生长刺激表达基因2蛋白(sST2) 可溶性生长刺激表达基因2蛋白(soluble suppression of tumorigenicity-2,sST2)的出现为提高AAS的诊断准确性提供了新的可能。sST2于1989年被Shinichi Tommaga首次描述[69],是一种可溶性循环受体,属于白细胞介素-1(Interleukin-1,IL-1)受体家族成员ST2的亚型之一[70],可与ST2的另一种亚型- 跨膜型受体(ST2 ligand,ST2L)竞争性结合白细胞介素-33(interleukin-33,IL-33),从而抑制IL-33/ST2L信号传导通路介导的抗心肌纤维化、抗心肌细胞肥大的心脏保护作用[71]。sST2化学性质较为稳定,血浆水平不受肾脏功能、体重指数等的影响[72]。sST2可由多种细胞分泌,如心肌细胞、心脏成纤维细胞、血管平滑肌细胞等,在多种疾病中均可升高,如炎症、肿瘤、自身免疫性疾病、心衰、AMI等[73]。研究显示,当血管平滑肌细胞受到牵拉刺激时,外周血中sST2浓度迅速升高,在发病后1h内即可检测到,6h内达到高峰,然后缓慢下降,持续时间可超过14d[74]。因此,sST2可作为心血管损伤生物标志物来指导临床工作。 2.4.1 在主动脉夹层中的应用 研究显示,在临床怀疑AD的患者中,sST2>34.6ng/mL 时,诊断AD的灵敏度为99.1%,<34.6ng/mL可用于排除AD;sST2>40ng/mL时,其诊断AD的准确度最高(90%),灵敏度为87.7%,特异度为91.3%;当sST2>50 ng/mL时,特异度为95%,可用于诊断AD;相比之下,D-二聚体>500ng/mL时,对AD诊断的灵敏度为87.7%,特异度为82.2%,且D-二聚体在AD和APE患者中浓度水平相似,而AD患者的sST2水平显著高于APE患者,可见sST2对AD的综合诊断价值优于D-二聚体[74]。因此,对于临床疑似AD 患者,可考虑检测sST2以助于诊断或排除AD。 s ST2升高也可见于多种疾病的病理生理过程,其升高程度具有鉴别诊断价值。研究表明,在AD患者中血浆sST2水平可达AMI患者的3倍、APE患者的5倍、心绞痛患者的3.6倍[74],sST2联合cTn及D-二聚体有助于AD与AMI和APE的鉴别诊断。AD主要影响的是人体最大的动脉,提示血浆sST2升高程度与血管损伤范围有关[74]。 因此,临床症状及影像学表现符合AD的患者,其血浆sST2浓度越高,预示其血管损伤范围越大,死亡风险越高。 2.4.2 在急性心力衰竭中的应用 研究表明sST2可辅助诊断急性失代偿性心衰。对有心衰症状和利钠肽升高的患者,sST2<35ng/mL提示急性失代偿性心衰的可能性小;35~70ng/mL 提示为轻中度急性心衰;>70ng/mL提示为重度心衰[75]。 sST2可用于评估心衰预后。血浆sST2水平越高,死亡风险越高,sST2可与其他生物标志物联合检测以提高对心衰预后评估的准确度[76]。2013年美国ACCF/AHA心衰指南推荐将sST2 作为急性和慢性心衰预后的补充标志物[77]。我国《国家心力衰竭指南2023》也推荐检测sST2 用于心衰的危险分层及预后评估(Ⅱa类推荐,B级证据)[78]。由于sST2在血浆中存在时间较长,诊断窗口期长,连续监测心衰患者sST2浓度变化趋势可为预后提供更多信息。sST2反映的是一个持续和长期过程,体现心肌纤维化的程度。心肌重构是心衰发生和发展的基本病理生理机制,主要表现为心室肥大和心肌纤维化。因此,sST2水平持续升高反映了心肌纤维化和心肌重构的持续进展。 2.4.3 在暴发性心肌炎中的应用 sST2在暴发性心肌炎(fulminant myocarditis,FM)的诊断与鉴别诊断中也显示出一定优势。研究显示,在临床怀疑心肌炎且血流动力学不稳定的患者中,血浆sST2>58.39ng/mL诊断FM的灵敏度为85.7%,特异度为94.7% ;动态sST2水平可反映FM病情的严重程度及变化情况;与cTnI和利钠肽相比,sST2在鉴别FM和其他可引起血流动力学不稳定的疾病(如AMI、扩张型心肌病和心脏瓣膜病)方面表现出更好的区分度[79-80]。 推荐意见7:对于临床怀疑为AD的患者,血浆sST2对AD的综合诊断价值优于D-二聚体;sST2联合cTn及D-二聚体有助于AD与AMI和APE的鉴别诊断;sST2可辅助利钠肽对急性失代偿性心衰进行诊断;sST2可用于鉴别FM和其他可引起血流动力学不稳定的疾病。 推荐意见8:AD患者血浆sST2水平越高预示其血管损伤范围越大、死亡风险越高;sST2可作为急性心衰预后预测的标志物之一,其水平持续升高反映了心肌纤维化和心肌重构持续进展。 2.5 利钠肽 急性胸痛的症状范围不限于胸部疼痛,还包括胸闷、憋喘及呼吸困难等不适。因此,可能的病因中也包括心衰等引起此类症状的疾病。利钠肽家族中的B型利钠肽(B-type natriuretic peptide,BNP)及其无活性同源片段—N末端B型利钠肽前体(N-terminal pro-B-type natriuretic peptide,NTproBNP)在心衰早期诊断、预后评估以及急性胸痛的鉴别诊断、危险分层方面具有重要作用,在临床上被广泛应用[49]。 利钠肽的主要生理作用包括利钠、利尿、扩张血管、抑制肾素-血管紧张素- 醛固酮系统、抑制交感神经系统、抑制心肌纤维化和心室重构等。刺激BNP 分泌的主要因素是缺血、应激及心室容积压力增大等病理状态下心肌张力的增加[81]。 2.5.1 在急性心力衰竭中的应用 及时而准确的诊断对于优化急性心衰的科学救治至关重要。利钠肽在心衰的早期诊断中具有核心作用。急 性心衰临床表现多样,诱发因素、伴随症状及合并症等与其他多种高危疾病相似,因此在诊断方面具有高度的不确定性。利钠肽检测具有客观性、可重复性和广泛可用性的显著优势,所有表现为新发或恶化的心衰症状(如呼吸困难和/或疲劳)的患者都应检测利钠肽,以利于早期诊断或排除心衰发作。2021年ESC 心衰管理指南建议,对于有心衰症状的患者,应检测血浆利钠肽作为初步诊断排除心衰;利钠肽浓度升高可支持心衰诊断,对预后评估有帮助,并可指导进一步的诊断性检查(Ⅰ类推荐,B级证据)[82]。2022年AHA/ACC心衰管理指南推荐,对于出现呼吸困难的患者,检测BNP 或NT-proBNP有助于诊断或排除心衰(Ⅰ类推荐,A级证据)[83]。BNP及NT-proBNP排除、诊断急性心衰的临界值见表5[45, 84]。
需要注意的是,BNP和NT-proBNP的检测值存在“灰色区域”。处于灰色区域的患者最终诊断通常是轻度至中度心衰,但仍需考虑导致BNP/NT-proBNP水平升高的其他原因,包括继发于APE、ACS、肺炎和肺心病的肺动脉高压以及右心室功能障碍等[85]。当患者存在心衰病史、颈静脉压升高和既往使用利尿剂等与心衰有关的其他临床特征时,灰区BNP/NT-proBNP 检测值提示心衰的可能性显著增加[85]。 BNP/NT-proBNP检测值水平与心衰严重程度呈正相关,可用以评估心衰患者短期及长期死亡风险。NTproBNP>5000pg/mL提示急性心衰患者短期死亡风险较高;>1000pg/mL提示长期死亡风险较高。动态监测BNP/NT-proBNP可作为心衰疗效评估的辅助手段,BNP/NTproBNP水平降幅≥30%可作为治疗有效的标准。心衰患者住院期间BNP/NT-proBNP 水平显著升高或持续高位,或降幅<30%,均预示再住院和死亡风险增加[1]。 2 .5.2 在急性冠脉综合征中的应用 心肌缺血/缺氧以及容量和/或压力超负荷引起的室壁张力增加均会导致BNP/NT-proBNP分泌增加[86]。2023年ESC ACS管理指南中提到BNP/NT-proBNP可提供cTn之外的关于死亡和其他不良事件的预后信息[6]。研究显示,在ACS患者中,NTproBNP作为一种极具预测价值的生物标志物,与年龄、高血压、心肌梗死病史、卒中、Killip分级和心率等临床指标结合,构建的缺血风险评估模型(BIPASS评分)能够将ACS 患者分为高、中、低三层风险等级,对缺血事件的判别能力显著优于国际上常用的GRACE 评分[87];NTproBNP结合年龄、口服抗凝药、肾功能不全、血红蛋白浓度、大出血(BARC≥ 3)病史、血小板计数、长期服用非甾体类抗炎药或激素、脑卒中病史及胱抑素C构建的生物标志物改良的高出血风险学术研究联盟(The Academic Research Consortium for High Bleeding Risk,ARC-HBR)出血风险评估模型,对ACS患者严重出血事件的判别能力显著优于ARC-HBR标准[88]。此外,NT-proBNP在指导NSTE-ACS患者抗心衰药物使用和疗效评估中也具有重要价值[89]。 2.5.3 在急性肺栓塞中的应用 APE引起的右心室负荷与心肌张力增加,可导致BNP/NT-proBNP分泌增加。因此,血浆利钠肽水平能够反映APE中右心功能障碍和血流动力学损害的严重程度[90]。Meta分析显示,入院时BNP/NTproBNP浓度升高的APE患者,早期死亡风险为10%,不良事件发生风险为23%[91]。研究表明,在血流动力学稳定的APE患者中,BNP/NT-proBNP浓度升高对预测死亡的特异度和PPV较低,但低水平检测值却对排除不良事件具有较高的灵敏度和NPV[92-93]。有研究曾使用NT-proBNP <500pg/mL来选择适于尽早离院居家治疗的APE患者[94]。若要增加预后预测的特异度,可以将临界值提高至≥600pg/mL[95]。 推荐意见9:对于有呼吸困难、憋喘等疑似合并心衰的患者,检测BNP/NT-proBNP有助于排除或诊断心衰;注意BNP/NT-proBNP的检测值存在“灰色区域”,除轻中度心衰外,还应考虑导致其升高的其他原因。 推荐意见10:BNP/NT-proBNP水平与心衰严重程度呈正相关,可评估心衰患者短期和长期死亡风险;在ACS患者中,NT-proBNP是评估缺血和出血事件的重要生物标志物;BNP/NT-proBNP水平可反映APE右心功能障碍和血流动力学损害的严重程度。 2.6 具有临床应用潜力的新型生物标志物 2.6.1 内源性活性醛 内源性活性醛可影响细胞生长、存活、代谢、炎症、氧化应激等多种生理及病理反应,引发“醛损伤”,进而参与心血管、神经、消化、呼吸等多系统疾病的发生与发展[96]。醛代谢紊乱会导致大量醛类物质蓄积,毒性醛可损伤细胞、组织,造成器官功能障碍,这种共性机制在多种高危胸痛中均有体现,如ACS、AD 和心脏骤停[97]。在人体动脉粥样硬化易损斑块组织及ACS患者血浆中均可检测到4-羟基-2-壬烯醛(4-hydroxy-2-nonenal,4-HNE)、丙二醛(malondialdehyde,MDA)、丙烯醛、乙二醛、脱氧葡萄糖酮醛和甲基乙二醛等脂肪醛水平明显升高。在ACS早期进行血浆脂肪醛检测,有助于早期预警、评估预后及指导治疗。在AD患者及动物模型主动脉组织匀浆中均发现MDA、4-HNE等水平显著升高,且醛代谢关键酶—乙醛脱氢酶2(aldehyde dehydrogenase 2,ALDH2)在AD 和ACS中发挥“双刃剑”作用。推荐在AD及ACS高风险患者中检测血浆脂肪醛水平和ALDH2基因型,以指导疾病防控。ALDH2基因突变型人群中AD发病率较低,但冠心病发病率较高,因此在AD高风险患者中应降低ALDH2的酶活性,而在冠心病高风险患者中则应有目的地诱导其活性保持在较高水平,如适当运动、保持健康的生活方式、适量乙醇刺激以及使用抗氧化剂硫辛酸等。心脏骤停心肺复苏后,血浆及心肌组织中可检测到脂肪醛(MDA、4-HNE 等)水平明显升高。脂肪醛可能通过羰基化修饰琥珀酸脱氢酶导致琥珀酸大量积聚,进而引起线粒体功能障碍和活性氧水平增加,导致复苏后心功能障碍。因此,复苏成功后应尽快检测血液脂肪醛水平,以利于心功能障碍预警,并指导救治策略选择[97]。 2.6.2 白细胞介素增强子结合因子3(ILF3) 白细胞介素增强子结合因子3(interleukin enhancer-binding factor 3,ILF3)是一种双链RNA结合蛋白,包括NF90和NF110两种亚型,通过和蛋白、mRNAs、双链RNA及小干扰非编码RNAs的结合来调节基因的转录、翻译、mRNA的稳定性和非编码RNA的形成[98]。在一项亚洲人群与AMI有关基因多态性研究中发现ILF3的rs2569512位点与AMI有显著相关性[99]。研究证实动脉粥样硬化斑块钙化增加斑块的不稳定性并导致斑块破裂,进而引发AMI[100]。高脂血症和糖尿病都是导致动脉粥样硬化斑块发生钙化和斑块破裂的常见原因。研究发现ILF3无论是在高糖还是高脂诱导的动脉粥样硬化斑块钙化中均发挥着重要作用[101-102]。巨噬细胞来源的ILF3可加速动脉粥样硬化斑块中巨噬细胞向M1表型转化和加剧炎症反应;而平滑肌细胞来源的ILF3通过促进平滑肌细胞向成骨细胞转化参与斑块钙化的发生发展[101-102],提示ILF3的升高与斑块的不稳定性密切相关。在人和小鼠的易损斑块以及内皮损伤后的新生内膜中均检测到ILF3的表达水平明显升高[102-103]。以上结果提示,ILF3可用于动脉粥样硬化易损斑块的早期识别,以及ACS 与慢性冠脉综合征(chronic coronary syndrome,CCS)的鉴别诊断。 推荐意见11:在ACS早期进行血浆脂肪醛检测,有助于早期预警、评估预后及指导治疗;建议在AD和ACS高风险患者中检测脂肪醛水平和ALDH2基因型,以指导疾病防控;心脏骤停复苏后应尽快检测脂肪醛水平,以预警心功能障碍并指导救治策略选择。 推荐意见12:ILF3可用于动脉粥样硬化易损斑块的早期识别,有助于ACS和CCS的鉴别诊断。 3 急性胸痛生物标志物联合检测 急性非创伤性胸痛病因繁多、病程复杂,根据疾病特点、危险程度及救治需求,通常可以分为三大类:①心肌缺血性胸痛;②致命性非心肌缺血性胸痛(APE、AAS、急性张力性气胸等);③非致命性非心肌缺血性胸痛(非特异性胸痛、胃食管反流、肋软骨炎、带状疱疹等)。急诊医师面对胸痛患者时,应强调“急诊思维”,即在全面考虑胸痛可能病因的基础上,结合病史、临床表现、ECG及生物标志物检测,有针对性地对患者进行早期诊断、鉴别诊断和危险分层,快速地将急性胸痛患者有序分拣为上述三类,实现高危患者早期救治和低危患者合理分流。 如果患者存在ACS、APE、AAS等高危胸痛的危险因素及发病特征,且出现以下三种情况中的至少一种时,即血流动力学不稳定、心电活动不稳定或提示急性心衰,应及时对症处理且尽早联合检测cTn(首选hs-cTn)、D-二聚体、sST2及BNP/NT-proBNP,以便对患者进行诊断与鉴别、危险分层、预后评估和治疗决策;如果没有上述三种情况,则可根据具体病因考虑,有针对性地检测一类或两类指标完成疾病的诊断或排除诊断,确诊后再联合检测其他指标实现危险分层和预后评估(表6,图4)。
需要注意的是,每一种成熟的标志物都有其特异性,在排除诊断方面更加优异,结合临床评估模型,更有利于优化临床决策流程(表1~表4,图1~图4)。而且,多种生物标志物联合检测的串联或并联效能等数据,今后尚需大量临床研究来丰富和完善。 高危胸痛中张力性气胸的诊断一般无需标志物检测,病史和查体即具有很强的提示意义,如患者为男性青壮年瘦高体型或患有慢性支气管炎、肺气肿、肺结核者,突发一侧胸痛伴憋喘,且一侧呼吸音明显降低甚至消失,可高度怀疑气胸的可能,应尽快行胸部X线片检查明确诊断。 非致命性非心肌缺血性胸痛,如胸膜炎、胃食管反流、肋软骨炎、带状疱疹等,通常依赖典型的临床表现以及排除其他致命性疾病后得以诊断。可根据临床实际情况选择需要检测的生物标志物。 综上所述,合理的生物标志物联合检测,能够为急性胸痛患者的诊疗提供更为客观的依据,有利于提高疾病诊断的灵敏度和特异度,提高危险分层及预后预测能力,避免漏诊和误诊,同时减少不必要的检查,缩短在院时间,提高医疗资源的利用效率。值得注意的是,由于急诊工作的特殊性和紧迫性,并不是所有患者都需要同时测定上述多种生物标志物,急诊医师应根据患者的临床表现和疾病的发展阶段,结合每种标志物的代谢动力学特点及临床意义,有针对性地进行标志物联合应用,并酌情进行相应的影像学或其他进一步检查。 推荐意见13:对于血流动力学不稳定、心电活动不稳定或提示急性心衰的患者,应及时对症处理且尽早联合检测cTn(首选hs-cTn)、D-二聚体、sST2及BNP/NTproBNP,以便对患者进行诊断与鉴别、危险分层、预后评估和治疗决策。 推荐意见14:对于生命体征相对稳定的患者,应根据临床表现提示的可能病因,有针对性地选取相应的生物标志物、CDP和评分模型进行评估,确诊后再联合检测其他指标实现危险分层和预后预测。 执笔:郑雯 李冉 商睿 陈良 潘畅 唐梦熊 魏述建 边圆 薛丽 王甲莉 庞佼佼 李传保(山东大学齐鲁医院急诊科) 专家组成员(按姓名拼音排序):蔡琳(成都市第三人民医院) 曹春水(南昌大学第一附属医院) 曹钰(四川大学华西医院) 柴艳芬(天津医科大学总医院) 陈步星(北京中医药大学第三附属医院) 陈凤英(内蒙古医科大学附属医院) 陈辉(北京急救中心) 陈茂(四川大学华西医院) 陈彦(江苏省人民医院) 陈玉国(山东大学齐鲁医院) 陈韵岱(中国人民解放军总医院) 程晓曙(南昌大学第二附属医院) 崇巍(中国医科大学附属第一医院) 楚英杰(河南省人民医院) 丛洪良(天津市胸科医院) 邓颖(哈尔滨医科大学附属第二医院) 丁邦晗(广东省中医院) 董鹏(杭州师范大学附属医院) 董少红(深圳市人民医院) 董士民(河北医科大学第三医院) 杜杰(首都医科大学心血管重塑相关疾病教育部重点实验室) 范西真[ 中国科学技术大学附属第一医院(安徽省立医院)] 费爱华(上海交通大学医学院附属新华医院) 封启明(上海市第六人民医院) 傅善基(山东大学齐鲁医院) 格桑罗布(西藏自治区人民医院) 葛玉梅(浙江省人民医院) 谷新顺(河北医科大学第二医院) 郭金成(首都医科大学附属北京潞河医院) 郭伟(首都医科大学附属北京中医医院) 韩小彤(湖南省人民医院) 韩学斌(山西省心血管病医院) 郝晓云(西安急救中心) 郝应禄(玉溪市人民医院) 何菲(天津市儿童医院) 贺晓楠(首都医科大学附属北京安贞医院) 贺玉泉(吉林大学白求恩第三医院) 洪玉才(浙江大学医学院附属邵逸夫医院) 侯爱洁(辽宁省人民医院) 胡信群(中南大学湘雅二医院) 黄亮(南昌大学第一附属医院) 贾绍斌(宁夏医科大学总医院) 江旺祥(武汉市急救中心) 蒋峻(浙江大学医学院附属第二医院) 蒋龙元(中山大学孙逸仙纪念医院) 蒋旭九(信阳市中心医院) 晋军(陆军军医大学第二附属医院) 荆全民(中国人民解放军北部战区总医院) 柯俊(福州大学附属省立医院) 孔立(山东中医药大学附属医院) 兰超(郑州大学第一附属医院郑东院区) 李保(山西医科大学第二医院) 李斌(海南省人民医院) 李春洁(天津市胸科医院) 李国庆(新疆维吾尔自治区人民医院) 李浪(广西医科大学第一附属医院) 李潞(沈阳医学院附属第二医院) 李茜(浙江省人民医院) 李惟铭(首都医科大学附属北京朝阳医院)李伟(贵州医科大学附属医院) 李晓鲁(山东第一医科大学第一附属医院) 李云波(云南省急救中心) 李治红(济宁医学院附属医院) 梁岩(中国医学科学院阜外医院) 林先和(安徽医科大学第一附属医院) 蔺际龑(厦门大学附属第一医院) 蔺亚晖(中国医学科学院阜外医院) 刘斌(吉林大学第二医院) 刘峰(上海交通大学医学院苏州九龙医院) 刘红梅(北京急救中心) 刘家良(济南市急救中心) 刘强(深圳市中医院) 刘欣(鞍钢集团总医院) 刘寅(天津市胸科医院) 刘泽金(武汉亚洲心脏病医院) 卢成志(天津市第一中心医院) 陆士娟(海口市人民医院) 罗素新(重庆医科大学附属第一医院) 马根山(东南大学附属中大医院) 马剑英(复旦大学附属中山医院) 马娟(昆明市第一人民医院) 马礼坤[ 中国科学技术大学附属第一医院(安徽省立医院)] 马林浩(上海长征医院) 马青变(北京大学第三医院) 马岳峰(浙江大学医学院附属第二医院) 米玉红(首都医科大学附属北京安贞医院) 聂如琼(中山大学孙逸仙纪念医院) 聂绍平(首都医科大学附属北京安贞医院) 潘曙明(上海中医药大学附属普陀医院) 齐晓勇(河北省人民医院) 钱菊英(复旦大学附属中山医院) 秦历杰(河南省人民医院) 曲新凯(复旦大学附属华东医院) 商德亚(山东省立医院) 沈桂冬(安康市中医医院) 沈密(青海红十字医院) 石蓓(遵义医科大学附属医院) 史继学(山东第一医科大学第二附属医院) 寿锡凌(陕西省人民医院) 宋大庆(济宁市第一人民医院) 宋光远(首都医科大学附属北京安贞医院) 宋振举(复旦大学附属中山医院) 孙鹏(华中科技大学同济医学院附属协和医院光谷院区) 孙树印(济宁市第一人民医院) 谭宁(广东省人民医院) 唐柚青(中国人民解放军南部战区总医院) 田刚(西安交通大学第一附属医院) 万智(四川大学华西医院) 王斌(汕头大学医学院第一附属医院) 王锦权[ 中国科学技术大学附属第一医院(安徽省立医院)] 王军(南京鼓楼医院) 王君业(青岛市急救中心) 王乐丰(首都医科大学附属北京朝阳医院) 王秀杰(厦门市苏颂医院) 王焱(厦门大学附属心血管病医院) 王长谦(上海交通大学医学院附属第九人民医院) 王志禄(兰州大学第一医院) 魏捷(武汉大学人民医院) 魏庆民(邢台市人民医院) 魏述军(宁夏回族自治区人民医院) 魏延津(临沂市人民医院) 吴俊荣(郑州市第二人民医院) 吴利东(南昌大学第二附属医院) 向定成(中国人民解放军南部战区总医院) 肖骏(重庆市急救医疗中心) 徐峰(山东大学齐鲁医院) 徐贵森(中国人民解放军西部战区总医院) 徐欣晖(上海交通大学医学院附属仁济医院) 徐亚伟(上海市第十人民医院) 薛玉增(聊城市人民医院) 燕宪亮(徐州医科大学附属医院) 杨海燕(烟台市烟台山医院) 杨丽霞(中国人民解放军联勤保障部队第九二〇医院) 杨清(天津医科大学总医院) 杨爽(哈尔滨医科大学附属第二医院) 杨艳敏(中国医学科学院阜外医院) 叶红华(宁波市医疗中心李惠利医院) 尹春琳(首都医科大学宣武医院) 由倍安[ 山东大学齐鲁医院(青岛)] 余再新(中南大学湘雅医院) 袁义强(河南省胸科医院) 张泓(安徽医科大学第一附属医院北区) 张虎(天津市蓟州区人民医院) 张剑锋(广西医科大学第二附属医院) 张蛟(北京电力医院) 张俊杰(南京市第一医院) 张玲(宁夏回族自治区人民医院) 张邢炜(杭州师范大学附属医院) 张雪莲(吉林省人民医院) 张钲(兰州大学第一医院) 赵光举(温州医科大学附属第一医院) 赵剡(武汉大学中南医院) 赵兴胜(内蒙古自治区人民医院) 郑金刚(中日友好医院) 郑晓晖(阜外华中心血管病医院) 郑杨(吉林大学第一医院) 郑昭芬(湖南省人民医院) 周光居(浙江大学医学院附属第二医院) 周建华(威海市中心医院) 周长勇[ 青岛大学附属医院(平度)] 朱华栋(北京协和医院) 利益冲突 所有作者声明无利益冲突 参考文献(略) 文章来自:中国医师协会胸痛专业委员会,中国医疗保健国际交流促进会胸痛学分会 急性非创伤性胸痛生物标志物联合检测共识(2024版)专家组.急性非创伤性胸痛生物标志物联合检测专家共识(2024版)[J].中华急诊医学杂志,2024,33(12):1681-1696. DOI号:10.3760/cma.j.issn.1671-0282.2024.12.005 (责任编辑:admin) |