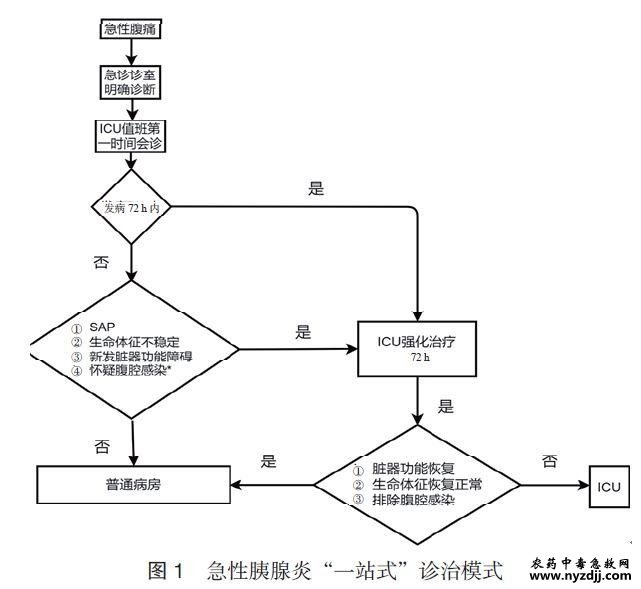
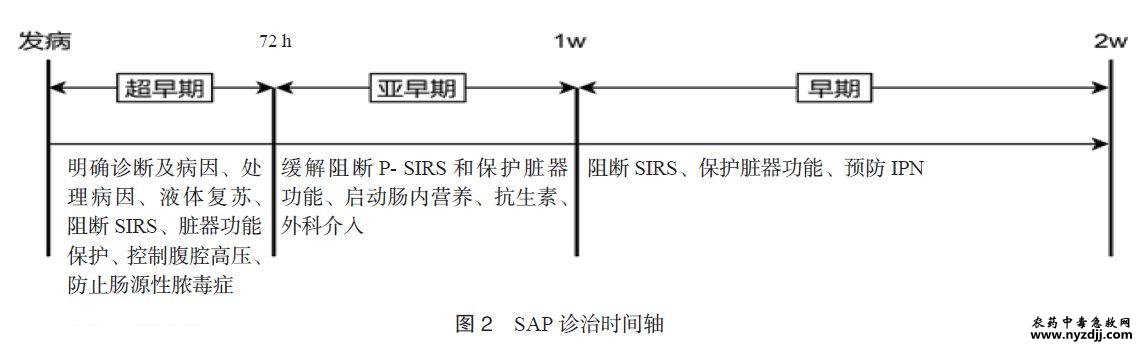
|
急性胰腺炎(acute pancreatitis, AP)的年发病率为(13~45)/10万人[1,2],约20%可发展为中度重症AP(moderately severe acute pancreatitis, MSAP)或重症AP(severe acute pancreatitis, SAP)。急诊科是此类患者第一次医疗接触的科室[3]。发病72 h内,病因持续存在、休克未及时纠正、脏器功能持续损害而易发展为SAP[4]。SAP的诊治呈现时间依赖性。急性反应期的合理处置有助于减少感染期“感染-出血-肠瘘”的发生。本急诊专家共识的目的在于将“急救”理念贯彻在AP急性反应期的治疗之中,按照时间依赖性的“急救”理念对“关键诊疗措施”进行定量或半定量的目标化管理。经四轮会议讨论、广泛征求意见得到了10余个具体临床问题,检索相关数据库,基于循证医学证据和推荐分级的评估、制定与评价(grading of recommendations assessment, development, and evaluation,GRADE)方法,将共识的证据等级分为三级(表1)。本共识注册编号:PREPARE-2023CN633。 1 急性反应期的定义及病理生理特点 目前已公认的SAP的临床分期分为急性反应期(1~2周)、感染期和残余感染期。急性反应期通常指病程的前两周,其特点为全身炎症反应综合征(systemic infl amatory response syndrome,SIRS)及器官功能障碍。根据SAP急性反应期的病理生理特点,可分为3个阶段[5-6]。 1.1 超早期(发病至72h) 病因、血容量丢失、休克和SIRS等因素可导致病情呈现持续加重状态,直至发病后72h达到疾病的高峰[4]。患者腹痛至就诊的平均时间为23h[7]。无论是院外还是院前,均是MSAP和SAP的黄金救治救治的关键阶段。 1.2 亚早期(72h~1周) 该阶段是缺血-再灌注后的再损伤阶段,超早期的SIRS状态可持续至该期而发生持续SIRS 状态(persistent systemic inflammatory response syndrome,P-SIRS)及多脏器功能障碍(multiple organ dysfunction syndrome,MODS)加重。 1.3 早期(1~2周) 该阶段内可呈现为3种状态,SIRS缓解、P-SIRS和MODS,是决定是否发生感染性胰腺坏死(infected pancreatic necrosis, IPN)和其他部位感染的关键时期。可见胰外侵犯、胆道、肺部和血流感染等,此时需密切监测降钙素原(procalcitonin,PCT)、微生物学、影像学、临床症状与体征等。 2 急性反应期医疗救治单元选择与急诊分级管理 明确急性反应期患者就诊的主体责任科室及对AP进行严格的分级管理对改善预后具有重要意义。 2.1 医疗救治单元的选择 2.1.1 救治医疗机构 发病72h内的SAP患者应通过调配必需的医疗资源就地抢救,在首诊医院内经过急救处置后,若血流动力学和呼吸功能相对稳定,经充分评估转运的获益及风险,可根据需求转运至获益更大的医疗机构。规范的转运流程是保证转运安全的基础。携带首诊医院的所有医疗资料;测算转运途中所需的氧气总量,保证转运途中有充足的氧源;持续心电监护;备足抢救用药;转运需由专业医疗团队完成[8]。凡具有综合救治急危重患者能力的急救中心均可收治SAP[9-10]。 推荐意见1:建议发病72h内的SAP患者就地抢救,评估转运风险后,可转运至获益更大的医疗机构。(证据水平:低) 2.1.2 救治科室 目前国内外尚无统一的急救模式。AP患者抵达急诊后,不同医疗单位的急救处置模式各异。我国AP患者的住院前(急诊诊室、抢救室)急救现状如下:(1)不同的就诊专科及接诊医生。患者可分布在急诊科、消化科和外科等。不同科室的医生对急救环节的处置存在差异。(2)收治的科室各异。不同医疗机构内,患者的住院科室存在差异,常见有普外科、肝胆胰外科、消化科和急诊科等。这容易发生急诊诊室、抢救室和收治科室之间的医疗干预措施连续性的中断,对实施规范化治疗带来困难。明确AP的诊治流程是急性反应期面临的巨大挑战。 建议有条件的医疗机构建立以某一专业科室为救治主体的多学科团队,患者住院期间均由该团队进行全流程管理。发病72h内的AP患者可收入重症监护病房(intensive care unit,ICU)或有监护条件的普通病区的重病房接受住院监护治疗,以及时发现循环与呼吸功能的异常。发病72h后,MAP和MSAP患者可转至普通病区(急诊科、消化科等)继续治疗;SAP患者需继续在ICU内接受强化治疗(图1)。 从预检分诊开始,由急诊医生首诊,然后发病72h内的AP患者由急诊ICU或其他ICU负责收治管理,同时邀请外科、消化科、内镜、营养、介入等多学科团队参与全流程诊治,建立“一站式”无缝隙管理模式的多学科诊治团队,更符合我国目前AP诊治的实际需求。 推荐意见2:AP患者通常由急诊医生首诊;建立以急诊为起点的“一站式”多学科诊治团队更有利于患者的救治。(证据水平:中) 2.2 急性胰腺炎的分级管理 1955年,De Nicola RR提出了AP的急救理念[10]。患者在急诊诊室、抢救室阶段的早期急救处置与ICU的治疗同样十分重要,与预后密切相关[10]。尽管发病72h内部分患者尚未达到Ⅱ级或Ⅰ级标准,但鉴于AP发病72h内有病情逐渐加重而发展为SAP的可能,故建议按急诊Ⅱ级患者进行管理,这符合《急诊患者病情分级指导原则( 征求意见稿)2011》[11]要求。患者抵达急诊诊室或抢救室后,急诊医生需根据实际情况进行分级处置。SAP患者属于Ⅱ级患者,且可能短时间内进展为Ⅰ级,因此应迅速安排接诊和收入抢救室或ICU。 推荐意见3:需动态评估发病72h内的AP患者病情,可按Ⅱ级患者的急救流程进行诊治管理(证据水平:高) 3 急性反应期“关键诊疗措施”的内容 AP无特效治疗措施,但有时间依赖性和直接与预后相关的诊疗措施。明确诊断、祛除病因可避免AP恶化和复发。有效的保护和维护脏器功能是SAP患者顺利渡过急性反应期的基石。 3.1 诊断及鉴别诊断 尽管AP的诊断标准已达成共识,但有假阳性和假阴性病例[12-13]。明确诊断和鉴别诊断是阻止病情恶化和防止延误其他急腹症治疗的基础。除血淀粉酶、脂肪酶外,详细询问病史和标准范围的腹部CT平扫(从胸腔至耻骨联合)作为诊断AP的必需标准受到高度重视[9]。其他急腹症和一些内科疾病的病理生理、临床表现与AP相类似,但其发病机制与AP完全不同。一类是胰酶原在胰腺外激活(十二指肠穿孔、胰周器官手术引起的胰腺损伤等);另一类是无胰酶原激活,全身急性中毒、局部组织炎症和糖尿病酮症酸中毒[14-15]等。此类疾病存在外科手术指征时,应第一时间请相关学科紧急会诊,而不能按照AP急性反应期的非手术治疗策略进行处置而延误诊疗。 推荐意见4:标准范围的腹部CT平扫是诊断AP的必需标准;应重视AP的鉴别诊断。(证据水平:高) 3.2 病因诊断 尽快明确和积极处理病因是阻断AP重症化的必需措施之一[16-17]。常见病因包括胆源性、高甘油三酯血症和酒精,较为少见的有高钙血症、肿瘤、病毒、药物、自身免疫病、胰腺解剖和功能异常等,约20%的患者有病因不明被归类为特发性AP。 (1)胆源性因素。是我国发生AP的第一位病因。目前多数诊断标准较为模糊,尤其是诊断的可操作性、准确率、阳性率等仍有争议。急性胆源性胰腺炎(acute billiary pancreatitis,ABP)的诊断标准需同时满足以下3个指标:发病72h内任何时间点的谷丙转氨酶/谷草转氨酶/总胆红素超过正常值;有导致胆总管下端发生梗阻或可能发生梗阻的影像学表现之一(胆道微小结石或泥沙样结石、胆总管囊肿、十二指肠憩室等);排除其他病因。这一诊断标准的优势是可操作性强及临床数据的同质性高[17]。一旦诊断为ABP,应即刻进行临床分型。根据胆总管状态可分为三型[18]。Ⅰ型为非梗阻型,是指单次肝内、外胆道的微小结石事件引起胆总管短暂梗阻。血清总胆红素轻度升高或不升高,无胆总管扩张;Ⅱ型为非完全梗阻型,是指胆道内或外因素导致的胆总管通而不畅或反复间断性梗阻,胆总管轻度扩张或不扩张;Ⅲ型为完全梗阻型,是指胆总管完全梗阻,不能自行缓解,常伴有急性重症胆管炎。该分型为尽快处理病因提供了科学依据。 (2)高脂血症因素。高甘油三酯血症性AP(hypertriglyceridemic acute pancreatitis,HTG-AP)是我国发生AP的第2位病因。其诊断标准:血清油三酯(triglyceride,TG)≥11.3 mmol/L,或TG在5.65~11.3mmol/L之间,且血清为乳糜状,并排除其他原因引起的AP[19-20]。 (3)高钙血症因素。AP患者的血钙升高,同时排除其他病因即可诊断。导致血钙升高的原因需要继续鉴别。 (4)复合型因素。指同时达到2个或以上常见病因的诊断标准,此类患者更易发生脏器功能障碍[21]。 3.3 液体复苏 及时的液体复苏是缓解和阻断SIRS/MODS和改善SAP预后的关键措施[9]。只有重度血容量缺乏的患者需要启动液体复苏流程。发病72h内,同时满足下述3项或以上即为重度血容量缺乏,心率≥120次/min、平均动脉压≥85mmHg(1mmHg=0.133kPa) 或≤60mmHg、动脉血乳酸≥4mmol/L、尿量≤0.5mL/(kg · h)、红细胞压积≥44%[22]。 3.4 缓解和阻断SIRS与脏器功能保护 抑制全身炎症反应目的是防止脏器功能损伤,而及时合理的保护脏器功能对改善预后有积极意义。阻断胰腺坏死、保护心脏、肺与肾功能等是显著改善预后的重要措施。尤其是需要最大程度地防止SAP并发急性肾损伤(acute kidney injury,AKI),这是死亡的独立危险因素,其发病率为7.9%,但其病死率是非AKI患者的3倍[23]。 3.5 营养治疗 肠内营养(enteral nutrition,EN)对改善病死率、多器官衰竭、全身感染和手术需求方面的影响均优于肠外营养(parenteral nutrition,PN)[24]。早期实施EN时,往往是滋养肠道为目的,如果无法达到热卡和蛋白的目标需求,建议短时间内应用PN,规范选择PN途径和标准化维护、尽可能恢复EN是预防感染的重要举措[25]。早期合理实施EN可以防止和降低胰腺内、外侵犯感染而显著改善预后。 3.6 肠道功能保护 SAP患者肠道功能损伤与死亡密切相关。急性胃肠损伤分级是SAP患者死亡的独立预测因子[26]。保护肠道功能可防止二次打击和肠源性脓毒症。 3.7 抗生素应用 预防性抗生素是针对坏死胰腺组织或胰外侵犯而言,不建议在AP早期阶段预防性使用抗生素,以免带来后续耐药菌和真菌感染增多[5]。但一项来自22个国家的9728例患者的回顾性资料显示,41%~82%的AP患者在早期即接受抗生素使用[27]。MSAP和SAP患者接受早期(发病72h之内)预防性使用抗生素可显著提高预后[28-29]。建议急性反应期内需根据AP病因、疾病严重度和PCT指导抗生素应用[30]。 3.8 减低腹腔压力 腹腔间隔室综合征(abdominal compartment syndrome,ACS)是指腹内压持续高于20mmHg 且导致新发器官功能障碍,伴或不伴腹腔灌注压低于60mmHg[31]。腹腔高压容易导致急性肾功能衰竭、呼吸衰竭和肠道功能衰竭。因此迅速降低腹腔内压力是防治MODS的核心措施。 推荐意见5:“关键诊疗措施”直接与SAP的预后密切相关,是核心的诊疗内容。(证据水平:高) 4 急性反应期“关键诊疗措施”的实施方案 4.1 病因处理 (1)胆源性病因。Ⅰ型(非梗阻型) 无需进行介入性处理,可给予松弛Oddi 括约肌的解痉药物。Ⅱ型(非完全梗阻型)是否需急诊处理胆道一直存有争议,建议急诊进行胆道引流。引流方法首选经皮经肝胆囊穿刺置管引流术(percutaneous transhepatic gallbladder drainage, PTGBD),次选经内镜鼻胆管引流术(endoscopic nasobiliary drainage, ENBD)。Ⅲ型(完全梗阻型),ENBD和PTGBD均可以,目前尚无依据哪种方法更好,可以根据实际情况选择。在上述两种方法失败后,建议开腹放置胆总管切开引流和留置“T”管[18],但禁止打开胰包膜减压。患者疾病稳定后,根除胆道疾病的方法与指征可参考其他指南或共识。 (2)高甘油三酯血症病因。降低TG的方法包括降脂药物、胰岛素及血液净化[32-33],模式包括血浆分离、血浆置换和血脂吸附等。 (3)高钙血症病因。紧急降低血钙的方法包括无钙置换液的血液滤过、双膦酸盐。由于降钙素降血钙疗效较低,不推荐常规使用。因甲状旁腺肿瘤引起的高钙血症,不建议在急性反应期内手术切除,需等全身炎症反应消失和无感染状态下再考虑手术。 (4)妊娠因素。MAP和MSAP可密切观察保胎,SAP应急诊终止妊娠。 (5)复合型病因。按照单一病因的处理原则进行干预。 推荐意见6:合并急性胆管炎、胆道完全梗阻或胆总管结石的患者行急诊内镜逆行胰胆管造影(ERCP)或PTGBD,必要时手术探查胆道。(证据水平高) 4.2 限制性液体复苏 (1)有效血容量扩充。限制性液体复苏显著优于快速大容量的液体复苏[22]。如果平均动脉压<60mmHg,则应在30min内,通过输注液体或加用多巴胺(一般不建议应用去甲肾上腺素)将平均动脉压提升至60mmHg以上。在此基础上,控制液体输注的速率在5~10mL/(kg · h),控制发病当日至发病3d内的输注总量,控制体液潴留。连续不间断每4h评估是否扩容达标。满足下述指标中的2项或以上即为扩容达标:①心率<120次/min ;②平均动脉压为65~85mmHg;③尿量≥0.5~1.0mL/(kg · h);④ 血细胞比容为35%~44%[22]。 (2)输注液体途径。主要有静脉和消化道途径。静脉途径液体复苏方便、快速和直接,可迅速改善血流动力学。但其缺点是易导致体液严重潴留而引起器官功能损伤。经结肠液体复苏是一种安全、简便、有效的方法。在显著改善血流动力学的同时,具有保护器官功能的作用[34],可根据实际情况选用。 (3)液体种类。乳酸林格液应作为晶体液的首选,即使在高乳酸状态下也可将其作为首选,乳酸林格液比生理盐水更能降低SIRS和C-反应蛋白[35],除非患者患有高钙原因导致的胰腺炎或严重的肝脏疾病。胶体液首选白蛋白,不建议选择血浆,以防止血浆中凝血因子导致的高凝而加重胰腺缺血。晶体液导致的腹腔内压力升高速率高于胶体液,因此两条血管通路以2:1比例的晶体与胶体同时输注。 (4) 复苏终点。金标准是氧债为零,但获取该指标的有创操作较大。由于SIRS消失与氧债为零存在直接关联,因此将其作为液体复苏终点指标。其他液体复苏终点指标可以根据实际情况选择。 限制性液体复苏需要把握好三个“控制”,即控制液体输注速率、控制发病当日至发病3d内的输液总量和控制体液潴留量。血容量扩充一旦达标,应恢复体液的正常分布。限制性液体复苏既要避免液体不足、又要防止液体过量,实际上是一种滴定式复苏方法,在复苏过程中需要连续不间断的每4h评估血容量,以达到最佳血容量状态。 推荐意见7:急性反应期内伴有重度血容量缺乏的SAP,应采用限制性液体复苏策略。(证据水平:高) 4.3 阻断SIRS 控制SIRS是防止MODS的关键步骤之一[36]。目前缓解和消除SIRS的方法包括药物、血液净化和外科介入等。建议静脉注射大剂量维生素C和大剂量乌司他丁,同时给予抗炎和抗凝双重作用的药物,如血必净。①药物。大剂量维生素C[200~300mg/(kg · d)]。持续静脉推注至交感神经风暴消失;广谱蛋白酶抑制剂乌司他丁(90万单位/d),具有对抗全身炎症作用,减少促炎介质的释放,缓解瀑布样级联反应引起的SIRS[37]。研究显示乌司他丁可以保护SAP患者的受损脏器,并减少新发的脏器功能障碍[38]。血必净在抗炎的同时也具有调节免疫的作用,可对多种炎性细胞因子发挥双向调节作用[39];还能通过保护内皮功能,抑制毛细血管渗漏和微血栓形成而阻断SIRS进展。血必净联合常规治疗,可显著降低炎症介质的水平,改善凝血功能,减少肺损伤等并发症及MODS的发生[40]。②血液净化。包括血液滤过、血浆置换、血液灌流等,但目前循证医学证据较为充分的是间断短时血液滤过(intermittent short venovenuous hemofi ltration,ISVVH)[41],在SAP早期(<72h)采用ISVVH,每次持续时间为4~12h,可降低促炎细胞因子的同时升高抗炎细胞因子水平等,从而缓解SIRS和阻断胰腺坏死,但长时间血液滤过会导致抗炎细胞因子过度释放而导致感染发生和病死率升高[42-43],不推荐持续血液滤过(continuous veno-venuous hemofi ltration,CVVH)。③引流胰腺外渗液。经皮穿刺置管引流术(percutaneous catheter drainage,PCD)可以缓解SIRS,但是腹腔穿刺引流可能增加外源性感染。一项Meta分析结果提示AP患者早期应用PCD可降低全因病死率、住院期间费用和住院时间[44],但PCD会显著增加SAP的28d腹腔感染风险[45]。④胃肠道功能保护:疏通肠道可减少毒素吸收而减轻SIRS,具体方法参见“4.6 疏通肠道与保护肠道黏膜”部分。⑤急性反应期容易并发胆道感染,需要及时鉴别并处理,以防SIRS加重。⑥镇痛、镇静。交感神经兴奋导致SIRS加重,因此需要通过镇痛镇静达到抗炎目的。 推荐意见8:积极通过药物(大剂量维生素C、乌司他丁、血必净、镇痛镇静药物等)和中药疏通肠道,有助于缓解和阻断SIRS。(证据水平:中) 推荐意见9:发病72h内对伴有SIRS的MSAP患者,启动ISVVH可阻断SIRS和胰腺坏死。发病72h后以阻断或缓解SIRS为目的的血液净化,首选ISVVH,不推荐CVVH。(证据水平:高) 4.4 脏器功能支持 (1)呼吸功能支持。高流量吸氧和有创机械通气是首选的方法。对限制性通气功能障碍的患者,在祛除病因后仍存在呼吸功能异常,建议即刻行有创机械通气。排除继发性因素导致的呼吸功能异常后,应尽快实施有创机械通气。面罩通气方式容易压迫经鼻营养管道、发生胃胀气,增加腹腔压力,故不推荐无创机械通气。 (2)肾功能支持。保证肾脏的灌注压在60mmHg以上。及时合理液体复苏、降低腹腔内压力、应用乌司他丁、中药复方制剂和ISVVH清除炎症介质等有助于改善肾脏灌注而降低AKI 的风险[29]。迅速降低腹腔压力是保护肾脏功能的又一重要方法,具体措施参见“4.8 ACS 的处理”。血液透析主要是针对小分子物质(水、电解质、肌酐、尿素氮等),不导致白介素-10 的释放,而血液滤过则是针对中分子物质,尤其是对细胞因子清除率较高,但是,血液滤过可以增加白介素-10的释放而导致免疫瘫痪[33]。因此,不伴有SIRS的AKI患者,首选间断血液透析( intermittent hemodialysis, IHD);伴有SIRS的AKI患者选择间断血液透析滤过(intermittent hemodiafi ltration, IHDF)。 推荐意见10:伴或不伴SIRS的AKI患者血液净化模式宜分别选择IHDF或IHD。(证据水平:中) 4.5 营养治疗 建议使用营养风险筛查(nutrition risk screening,NRS2002)对AP患者进行营养风险的评估[46]。对急性反应期的患者,可按照目标25~35kcal/(kg·d)和蛋白质1.2~1.5g/(kg · d)(1 kcal=4.184kJ)进行补充,2周后的喂养目标参见其他指南或共识。对超过5 d仍未能启动EN的患者或喂养不达标,可短期使用PN。 (1)EN支持的途径。虽有文献支持通过鼻胃管(nasogatric tube,NGT)的途径实施早期EN[47],但发病72h内的AP患者,在血流动力学稳定的前提下,尽快留置鼻空肠管(nosojejunal tube,NJT),以防止后续病情恶化导致NJT留置困难。SAP患者建议留置NJT;MSAP患者可尝试NGT喂养,如果无法耐受可改用NJT。NJT的远端位置必须位于屈氏韧带下20~30 cm的位置,降低营养液的反流和消除患者“假性腹胀”的感觉。所有NGT和NJT留置后务必经影像学证实管道处于正确位置后方可实施EN。 (2)EN选择。营养治疗类型比较复杂,根据成分不同,EN制剂分为要素型、非要素型、疾病特异型、组件型四类。NJT途径建议选择要素型(短肽型)EN制剂。不建议选择要素饮食,因容易增加胃酸分泌;急性反应期禁止补充益生菌[48]。 (3)EN输注方法。对于NJT途径,建议采用持续输注的方法,从20mL/h逐渐增加到100 mL/h。对于经胃喂养的患者,也建议持续输注,其速率为30~100mL/h。 (4)EN不耐受。是指由各种原因所致的肠内喂养中断,无法达到患者营养需求,EN启动72h后未达到20kcal/(kg · d)[49]。EN不耐受的患者可启动PN。 (5)再喂养综合征(re-feeding syndrome,RS)。RS是指在长期饥饿后提供再喂养( 包括经口摄食、EN或PN) 所引起的、与代谢异常相关的一系列表现[50]。文献报道诊断AP后3d 内死亡患者中约20.5%的患者诊断为RS[51]。临床特点包括营养摄入不足超过5d、启动营养前电解质紊乱,尤其是低磷血症通常被认为是RS的标志。直接死亡原因包括:感染性休克、心源性休克和心律失常。考虑到RS的致命后果,早期发现和预防至关重要。建议对于SAP 患者尤其是慢性酗酒者,在开始营养治疗前应纠正电解质紊乱;对于严重体液和电解质失衡的患者,建议10kcal/(kg · d)的最大速率在4~7d内缓慢开始能量补充。还需补充B族维生素、钾、磷、钙和镁水平。 推荐意见11:SAP患者的营养治疗首选经NJT进行EN,MSAP患者可尝试经NGT进行EN。(证据水平:高) 4.6 疏通肠道与保护肠道黏膜 应用输液泵按照5~10 mL/(kg · h)的速率经留置的肛管内输注乳酸林格液(非高钙血症患者)或生理盐水,直至排便;同时肌肉注射新斯的明0.5~1mg/次,每天总量不超过5mg。第一次排便后,可经NJT、肛管内灌注生大黄、大承气汤、柴芩承气汤或清胰汤等中药。 4.7 抗生素 无论哪种病因的MAP均建议不使用抗生素。胆源性MSAP患者使用喹诺酮类和甲硝唑或头孢哌酮与甲硝唑,SAP患者建议使用碳青霉烯类抗生素,1周后感染未控制则加用抗革兰阳性球菌的药物。高脂血症病因的MSAP不应用抗生素,SAP时使用三代头孢联合甲硝唑。建议其他病因的SAP给予三代头孢联合甲硝唑,MSAP不建议给予抗生素[30]。研究发现,入院时PCT升高提示胆源性胰腺炎合并早期的细菌感染,是并发症发生的危险因素[52]。PCT可用于指导AP患者的抗生素选择[53]。 推荐意见12:AP急性反应期内,根据病因、疾病严重度进行分级选择抗生素。(证据水平:中) 4.8 ACS的处理 SAP的腹腔高压分为涨气型(Ⅰ型)和液体型(Ⅱ型)[9]。SAP患者应当常规监测腹腔内压力,并在限定的时间内将腹腔压力降至安全范围内。Ⅰ型和Ⅱ型腹腔高压的干预策略包括“疏通肠道、负水平衡、血液滤过、镇痛镇静、神经阻滞、肝素抗凝和外科干预”。镇静肌松和神经阻滞不但可缓解SIRS,而且可以降低腹腔内压力[54]。根据腹腔高压类型和按照从无创到有创的原则组合,选择适合方法降低腹腔内压力。 4.9 镇痛与镇静 非甾体抗炎药可用于AP引起的轻或中度疼痛;多个指南和共识推荐哌替啶作为首选镇痛药物[29],但需注意其代谢产物蓄积,导致癫痫、震颤等不良反应,且因其半衰期相对较短,无法满足AP持续镇痛的需求等缺点。传统认为吗啡会导致Oddi括约肌功能障碍[55],但随后研究并没有证实吗啡对AP患者预后有不良影响[56]。文献报道盐酸二氢吗啡酮的镇痛效果优于吗啡和芬太尼[57],丁丙诺啡与哌替啶具有相似的镇痛能力,但其优点是半衰期更长且成瘾性较低[58]。对于急性反应期的HTG-AP患者,应避免应用丙泊酚,因其配方中含有脂肪乳。胸段硬膜外阻滞可阻滞交感、感觉及运动神经,产生良好的镇痛、肌松、血管舒张以及副交感神经相对兴奋作用,可改善胰腺组织灌注,缓解炎症,并降低30d病死率[59],较常规镇痛具有明显优势效应。 推荐意见13:根据疾病情况选择合适药物对AP患者常规进行镇痛、镇静治疗。(证据水平:低) 4.10 外科介入治疗 急性反应期内,部分SAP患者仍需要接受外科介入治疗。①常见的外科介入指征。液体型腹腔高压、急性化脓性胆管炎、诊断不明确的急腹症和非手术治疗(包括PCD)24~48h无效。②外科介入方法。经皮腹腔或后腹膜穿刺置管引流术(PCD)、PTGBD 和ERCP解除胆总管梗阻;开腹手术,无法用内镜技术和PTGBD解决的胆道梗阻,需要开腹手术行胆总管探查并留置“T”管。经过24h强化治疗后脏器功能持续恶化的SAP患者,建议开腹手术,但手术时严禁打开胰腺包膜,只有在包膜下有积液的患者方可行胰腺包膜切开引流术。 4.11 中医中药 中医药应尽早积极地介入,结合病情辨证选用疏肝理气、清热解毒、活血化瘀或益气养阴等治法中药,辅以针刺、外治及穴位注射,目的是促进胃肠动力、减轻炎症反应、改善微循环障碍、防止器官功能障碍。临床上常用的中药,包括大承气汤、大柴胡汤、清胰汤等,其中均含有大黄成份。现代研究证实单味大黄在SAP的早期对胰腺细胞有一定的保护作用[60];大承气汤可通过下调白介素6、肿瘤坏死因子α等促炎细胞因子的释放,清除循环中已产生的炎性因子,阻断SAP的炎症风暴并重建促炎和抗炎细胞因子的平衡,进而减轻组织损伤[61]。多项研究表明早期应用大承气汤类药物可明显降低腹内压,促进肠动力,减轻肺损伤,减轻器官损害。具有通里攻下功效的中药复方可能降低 AP急性期患者的炎性因子水平[62]。针刺法主要以ST 36(足三里)和RN 12(中脘)两穴位刺激为主。2019年一项荟萃分析表明,电针干预辅助治疗 SAP可提高总有效率和改善胃肠功能,缩短恢复饮食时间和住院时间[63]。2022年的一项纳入专门针对针刺缓解 AP患者腹痛腹胀的疗效性和安全性的荟萃分析结果显示,针刺联合常规治疗在提升总有效率、 缓解腹痛腹胀和缩短腹痛缓解时间方面显著优于单独常规治疗[64]。皮硝,别名朴硝、盐硝、海皮硝、毛硝、硝百朴。其味咸,性苦、寒,归胃、大肠经。有泻热通便,润燥软坚,清火消肿之功效[65]。针对急性反应期AP患者,采用皮硝全腹外敷治疗,可使局部血管扩张、血流加快、改善微循环,增强单核细胞的吞噬能力,促进炎症的吸收与消散[66]。腹痛持续时间、开放流质饮食时间、住院时间均较对照组缩短,且并发症较少、中转手术率较低[67]。皮硝腹部外敷的规范,类似子弹袋形状的棉质布袋;皮硝外敷的范围,上至剑突、下至耻骨联合、两侧至腋后线;每次皮硝用量是棉质布袋体积的一半,摊平后外敷腹部;疗效观察,皮硝外敷后可见中药溶解在皮肤上,待其皮硝布袋成型后更换新的中药布袋,需要24h持续外敷。当皮硝布袋外敷12h以上仍未见药物溶解,则可停止外敷。 推荐意见14:中药大承气汤及其类方,针刺及腹部皮硝外敷可用于AP的早期治疗。(证据水平:中) 5 急性反应期实施“关键诊疗措施”的时间管理 “关键诊疗措施”的实施和达标影响患者预后。加强SAP急性反应期内实施“关键诊疗措施”时间管理则是改善预后的关键环节(图2)。 5.1 超早期 在该阶段内,按照“ 黄金1小时”的急救理念[9]进行液体复苏、阻断SIRS、处理病因和保护脏器功能[4]。 (1)病因。在入院前(抢救室)期间启动处置ABP和HTG-AP的病因,尽快解除胆道梗阻和非完全梗阻状态;将血TG降至5.65mmol/L以下[68]。在入院前(抢救室)采取治疗措施尽快将高钙血症AP的血钙水平降至正常水平。妊娠导致的AP,还需要按照疾病严重程度尽快对妊娠状态做出决策。 (2)液体复苏。确诊重度血容量缺乏后即应迅速启动液体复苏的流程,且扩充有效血容量应在入院24h内达标,扩容达标后即刻转为调整体液分布。 (3)缓解和阻断SIRS。早期及时采取综合措施缓解和阻断SIRS是防止MODS的重要策略,启动阻断SIRS的策略越早,疗效越佳。以阻断SIRS和阻断胰腺坏死为目的的ISVVH的最佳启动时间在发病后72h内,启动越早,疗效越佳[41]。 (4)脏器功能保护。①在规范实施限制性液体复苏6h后,呼吸功能仍无法同时达到下述4 项指标(呼吸频率<30次/min、SaO2>95%、PaO2>80mmHg、AaDO2<300mmHg),应尽早启动高流量给氧或有创机械通气。②抢救室是挽救肾脏功能非常关键的场所。患者抵达抢救室后,第一时间即应迅速判断肾前性、肾性还是肾后性肾功能不全。最为关键的是,发病72h 内的少尿或无尿患者,需做严格的补液试验,且在30~60min内明确肾脏的功能状态,以挽救濒临衰竭的肾脏[15]。 (5)腹腔高压的处理。腹腔高压持续时间越长,导致远隔脏器功能损伤的风险越高。一旦发生腹腔高压即应开始实施干预,且24h内必须将腹腔压力降至20mmHg以下,否则容易发生或加重多脏器衰竭。 (6)防止肠源性脓毒症。入院24h内清除肠道内的宿便,确保肠道通畅,患者排便后,继续使用大承气汤保护肠道[61];发病后3~5d内启动EN,以稳定肠道正常菌群。 推荐意见15:EN启动时间应限制在SAP发病后3~5d内。(证据水平:中) 5.2 亚早期 (1)P-SIRS。每日进行ISVVH,直至SIRS消失。 (2)营养治疗。在规定的时间内启动EN,这一策略的实施具有高度的时间依赖性。EN启动时间应限制在发病后3~5d内[69], 不推荐在发病后48h内启动EN。是否有肠鸣音不是启动EN的标准。在该阶段内,需要积极干预,尽快同时达到以下3个条件即可启动滋养性肠内喂养:血流动力学稳定(即使应用升压药)、腹腔内压力小于20mmHg和肠道已疏通。 (3)抗生素。因患者就诊时间的延迟[7],故大部分胆源性MSAP、SAP就诊时可能已存在胆道感染,甚至胰腺组织感染。该阶段应用的抗菌药已不再属于预防胰腺坏死组织感染的范畴。建议在MSAP和SAP早期(发病72h~1周)给予抗生素的使用,有助于改善预后[28-29]。 (4)外科手术。急性反应期不是外科手术指征的绝对禁忌证。在这一阶段内,需要高度警惕是否需要外科手术。一旦发生以下几种情况应与外科医生协商,在12h内尽早行外科手术治疗:①对诊断不清的急腹症剖腹探查;②对非手术治疗措施(包括PCD)反应性低下或无法解决的腹腔高压;③ ERCP和PTGBD均无法解决的完全性胆道梗阻。 (5)预防感染期创面出血。AKI是IPN患者腹腔内大量出血的独立危险因素[70]。AKI诊断一旦成立,即应启动降低感染期腹腔出血的流程,应用大剂量乌司他丁联合大剂量维生素C持续2周[9]和持续控制血肌酐水平在300μmol/L以内是预防出血的重要措施。 5.3 早期 该阶段内,按照时间依赖性诊治感染是重中之重,应在第一时间识别出有无感染以及有无IPN的发生;另外,如果SIRS状态持续1周以上,则应当加用抗革兰阳性球菌的抗生素。 推荐意见16:AP患者在抢救室期间即应开始按诊疗时间轴实施“关键诊疗措施”。(证据水平:高) 总之,AP急性反应期病情呈动态变化,在现有治疗模式下,按照“急救理念”的时间轴实施“关键诊疗措施”可缩短脏器损伤时间,避免灾难性后果。“关键诊疗措施”作为集束化的诊治措施,其特点在于目标导向和时间依赖,第一时间内实施规范、合理的急救诊疗干预才能显著改善患者预后的决策效率。 执笔人:车在前(上海交通大学医学院附属瑞金医院急诊科) 共识专家组成员(以姓名拼音为序):蔡文伟 曹钰 曾红科 曾俊 柴艳芬 陈玉国 杜俊凯 杜奕奇 甘涛 韩小彤 何小军 李小刚 林兆奋 吕传柱 马渝 马岳峰 毛恩强 潘龙飞 潘曙明 彭鹏 秦历杰 宋振举 孙备 童朝阳 王国兴 王振杰 吴青峰 夏庆 谢苗荣 邢吉红 徐善祥 许志伟 张国强 赵刚 朱继红 祝荫 邹多武 利益冲突 所有作者声明无利益冲突 参考文献(略) 文章来自:中华医学会急诊医学分会,上海市医学会急诊专科分会. 急性胰腺炎急诊诊治专家共识[J].中华急诊医学杂志,2024,33(4):470-479. (责任编辑:admin) |